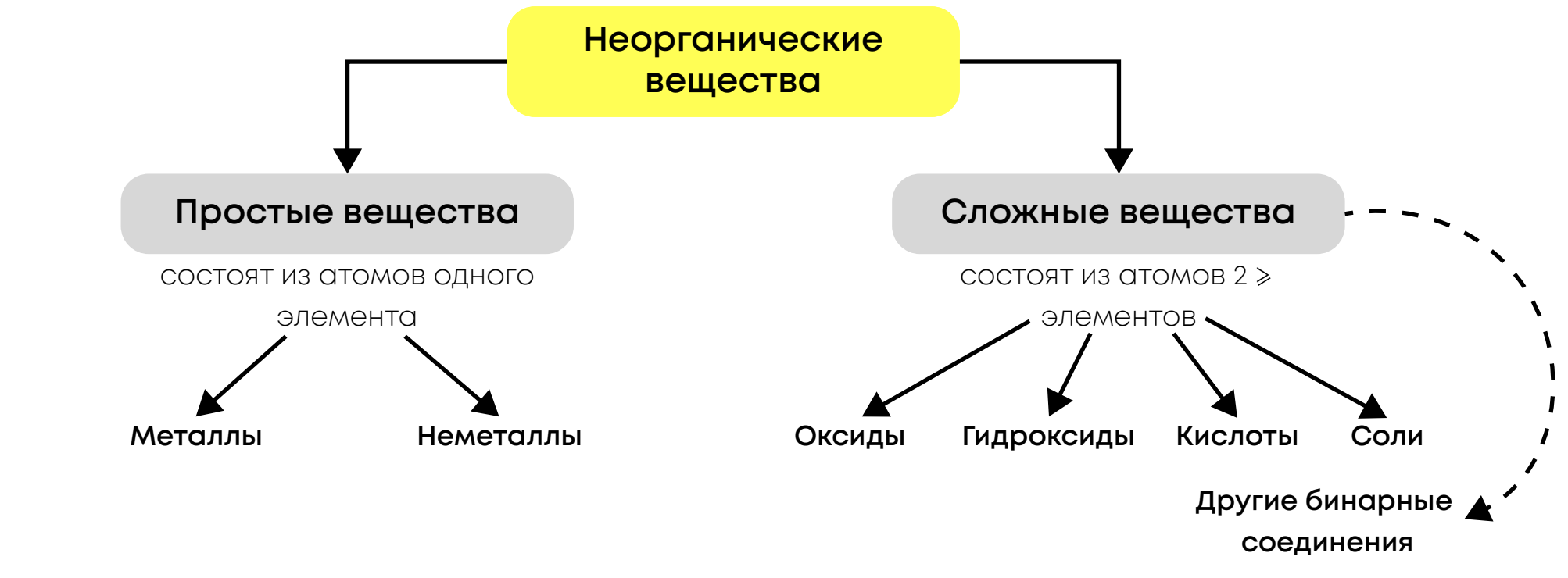
Все вещества в химии разделяются на два больших класса: неорганические и органические.
Неорганическая химия – это раздел химии, изучающий неорганические или минеральные вещества, то есть все вещества кроме соединений углерода – органических веществ
Мы говорим, что соединения углерода – органические соединения. Но есть ряд веществ с углеродом, которые относятся к неорганической химии: формы углерода C, угарный газ CO, углекислый газ CO2, карбиды CaC2, циановодород HCN, цианиды KCN, бинарные соединения углерода СF4.
Общая классификация неорганических веществ:
Простые вещества состоят из атомов одного химического элемента:
Неметаллы – простые вещества элементов-неметаллов, иногда
инертные газы (He, Ne, Ar, Xe, Kr, Rn) выделяют отдельноПримеры: F2, Cl2, Br2, I2, O2, N2, O3, C, P, S, Si
Металлы – простые вещества элементов-металлов
Примеры: Cu, Na, Ca, Li, Fe
Сложные вещества состоят из атомов нескольких химических элементов:
Оксиды – бинарные соединения элемента с кислородом, где
кислород проявляет с.о. -2Примеры: CaO, Al2O3, Cl2O7
Гидроксиды – соединения элемента с кислородом и водородом, где присутствует гидроксильная группа (-ОН)
Примеры: NaOH, Zn(OH)2, H2SO4
Кислоты – соединения, распадающиеся на катион
водорода и анион кислотного остаткаПримеры: HCl, HNO3
Соли – соединения, состоящие из катиона металла или аммоний-иона (NH4+) и аниона кислотного остатка
Примеры: NaCl, KHCO3, Na2[Zn(OH)4]
Другие бинарные соединения, которые выделяем отдельно: нитриды NH3, фосфиды PH3, карбиды CaC2, силициды Mg2Si, гидриды KH, галогениды PCl5 и т.п.
Классификация оксидов:
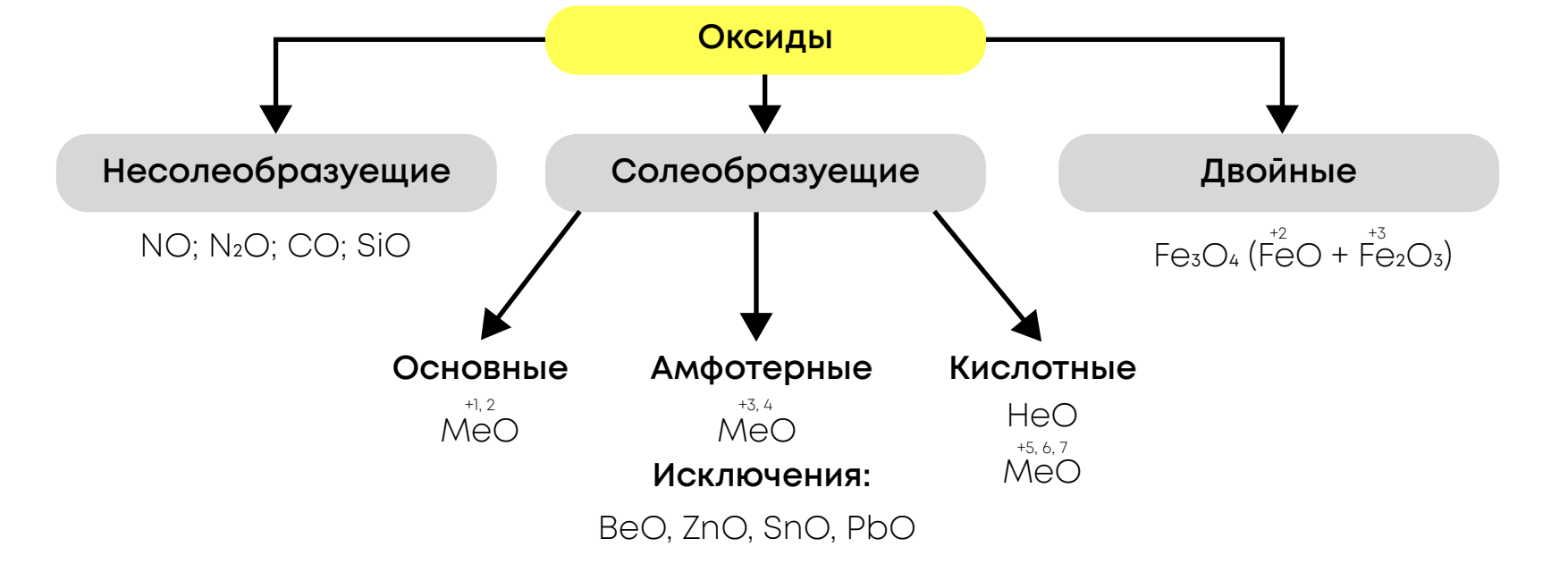
Оксиды легко отличать друг от друга, ориентируясь по схемке выше и степеням окисления.
Несолеобразующие оксиды – оксиды, не образующие солей, нужно просто запомнить
Солеобразующие оксиды – оксиды, образующие соли при реакции с основаниями/кислотами или между друг другом
Двойные (солеобразные) оксиды – оксиды, содержащие в составе металл в двух степенях окисления; для ОГЭ нужно запомнить железную окалину (смесь двух оксидов железа (II и III))
Классификация гидроксидов:
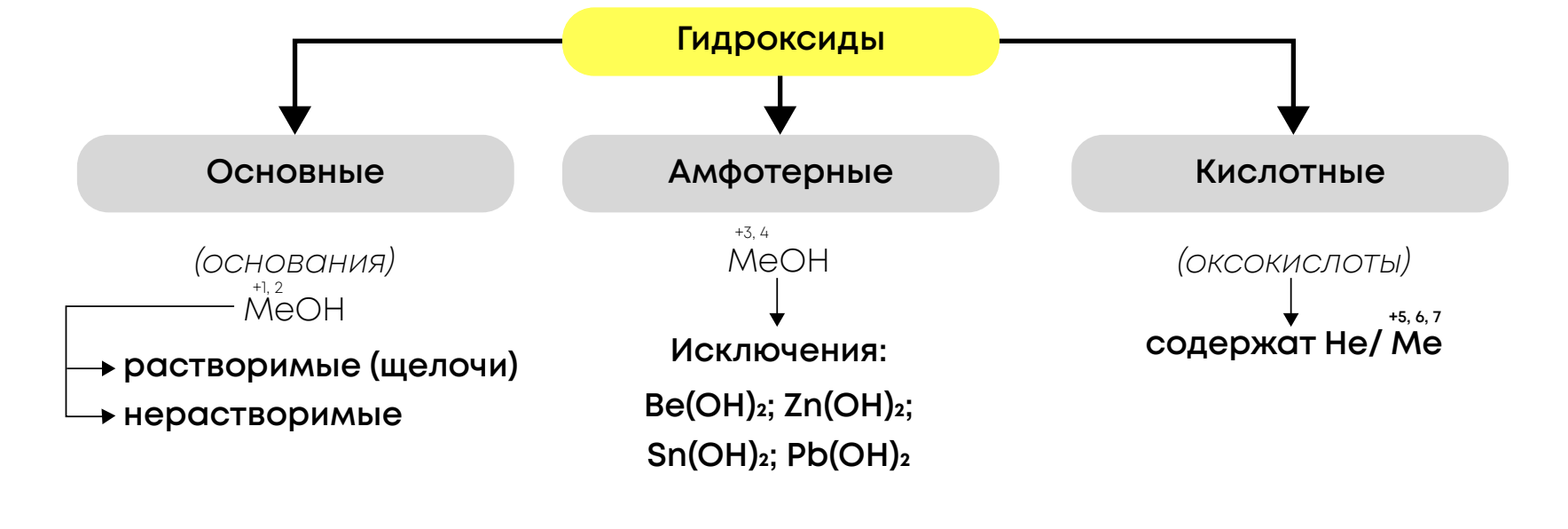
Нашатырный спирт/гидрат аммиака/гидроксид аммония: NH4OH или NH3•H2O относится к слабым основаниям (не щёлочь), хоть и растворим
Солеобразующие оксиды соответствуют гидроксидам:
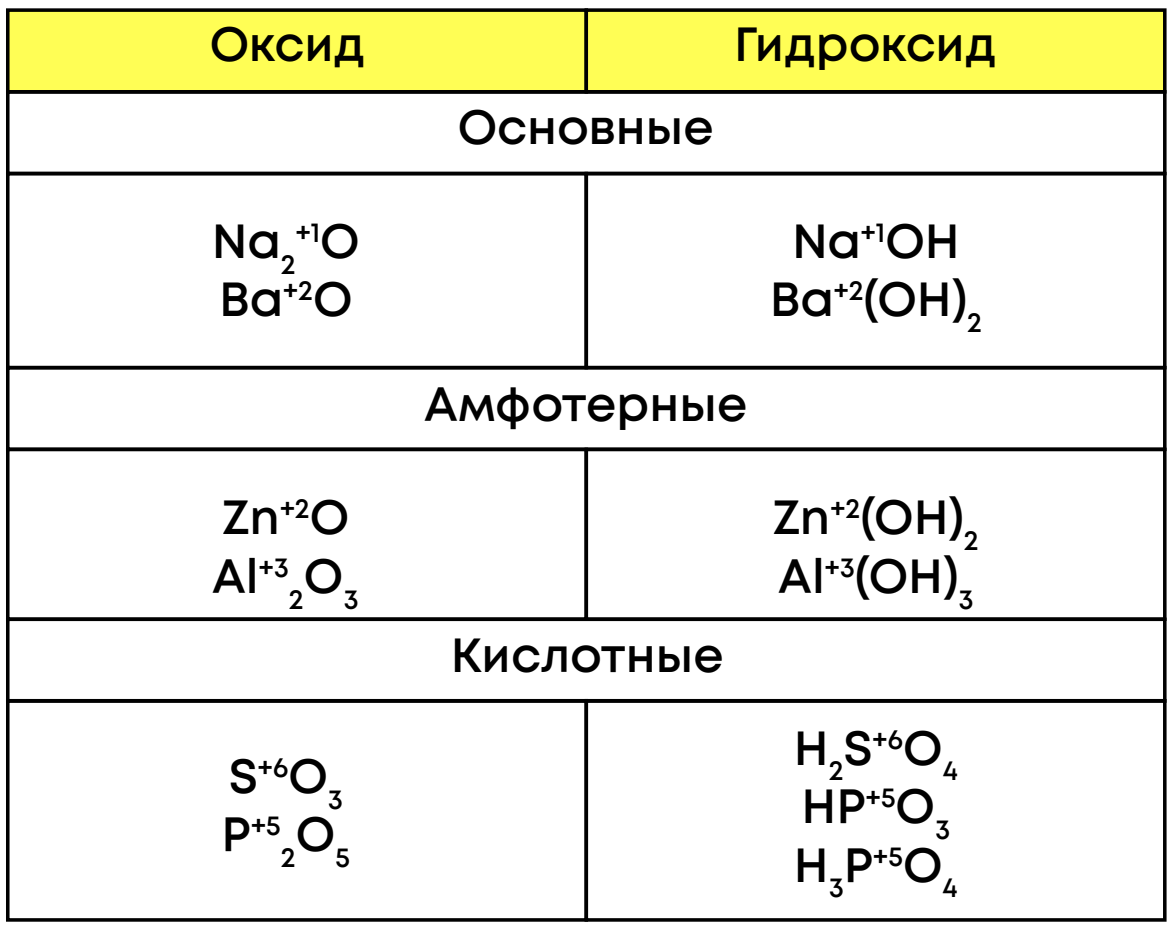
Важно: оксид NO2 соответствует двум кислотам: азотистой HNO2 и азотной HNO3
Классификация кислот:
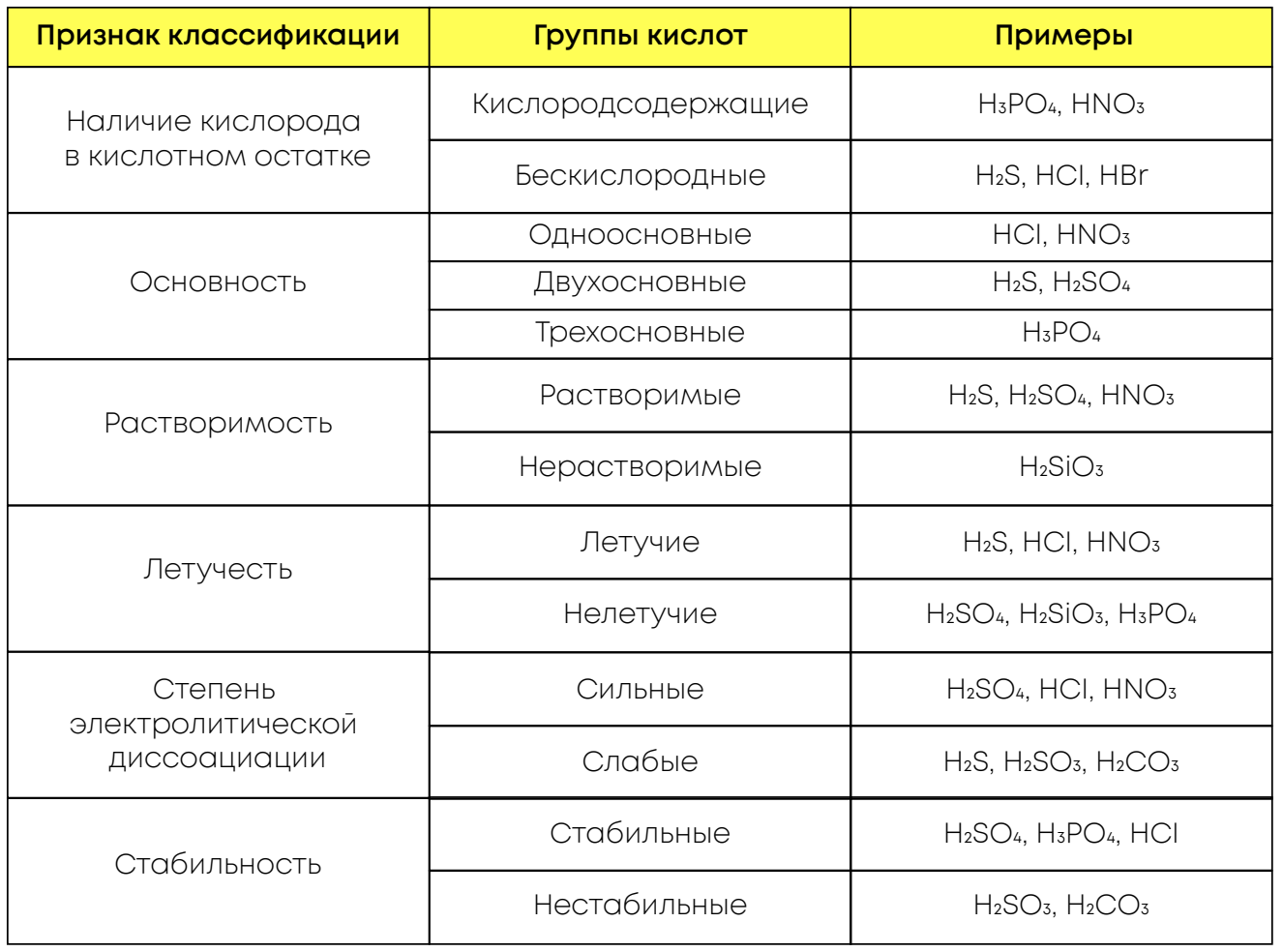
Классификация солей:
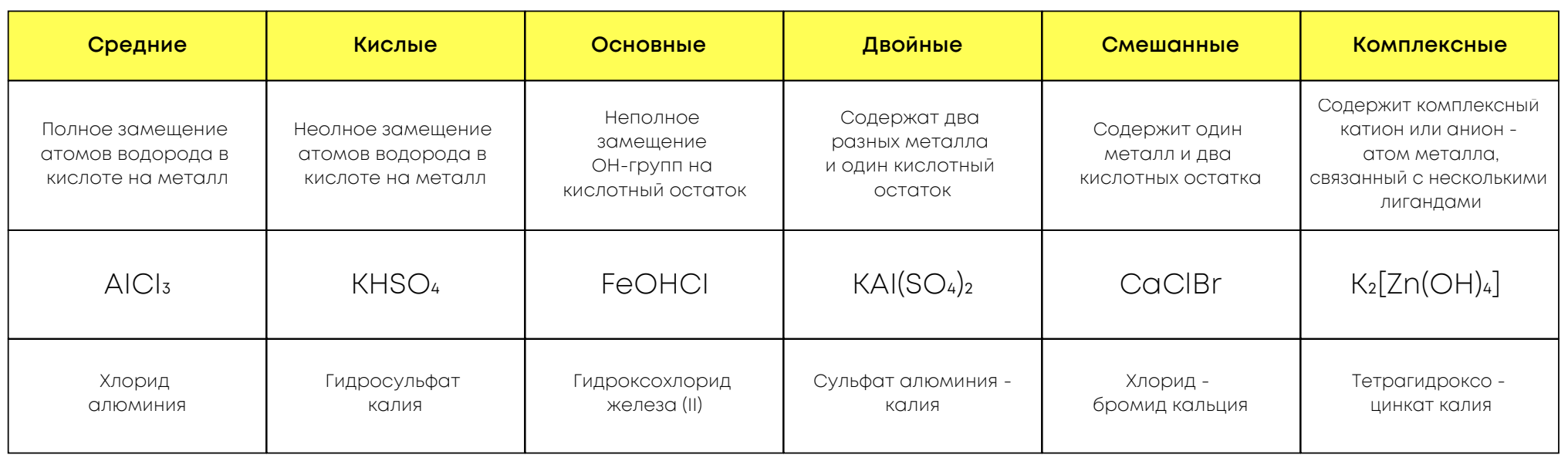
Кристаллогидратные соли при кристаллизации захватывают в кристаллическую решётку молекулы воды – кристаллизационную воду
Пример: медный купорос или пентагидрат сульфата меди (II) CuSO4•5H2O