Все процессы, наблюдаемые с веществами мы можем поделить на две группы: физические и химические явления.
Физические явления – это процессы, которые не сопровождаются образованием новых веществ: смена агрегатного состояния, перемешивание веществ, деформация, примагничивание и т.д.
Химические явления сопровождаются превращением одних веществ в другие: горение, ржавление, прокисание молока и т.д.

Все химические явления обусловлены протеканием химических реакций:
Химическая реакция – процесс превращения одного или нескольких веществ в другие вещества, при этом исходные вещества (реагенты) превращаются в продукты реакции из-за перераспределения атомов или ионов
У химических реакций есть условия, необходимые для их протекания. Условия реакции указываются над стрелкой или знаком равенства в уравнении реакции.
- Контакт реагентов
- Нагревание (t)
- Облучение светом (hν)
- Электрический ток
- Повышение давления (P)
- Введение катализатора – дополнительного вещества, повышающего скорость взаимодействия (кат.)
- Специфический растворитель (вода
для ионных реакций, к примеру)
Часто реакции имеют признаки протекания – внешние заметные признаки, по которым мы можем понять, что химическая реакция идёт.

М. Ломоносовым был открыт важный закон протекания реакций – закон сохранения масс: масса веществ, вступивших в реакцию, равна массе веществ, образовавшихся в результате реакции веществ. Это значит, что масса не может пропадать в никуда и появляться из неоткуда, т.к. химические реакции протекают как перекомбинация частиц вещества.

Для записи химической реакции используют уравнение реакции (когда количество атомов слева и справа от стрелки уравнено) или схему реакции (когда процесс обозначен схематично и он не уравнен), где сам процесс обозначается как “=”, “→” или “ ⇄”.

Как уравнять реакцию?
1. Метод подбора: последовательно уравниваем количество элементов слева и справа коэффициентами.
1) Дана химическая реакция в виде схемы:
Al2O3 + HCl = AlCl3 + H2O
2) Замечаем, что алюминия слева 2, а справа 1. Ставим коэффициент 2 справа:
Al2O3 + HCl = 2AlCl3 + H2O
3) Считаем хлор: слева 1, справа 6. Ставим коэффициент 6 слева:
Al2O3 + 6HCl = 2AlCl3 + H2O
4) Считаем водород: слева 6, справа 2. Ставим коэффициент 3 справа:
Al2O3 + 6HCl = 2AlCl3 + 3H2O
5) Коэффициенты везде расставлены, проверяем по кислороду: слева 3 и справа 3. Реакция уравнена!
2. Подбор через наименьшее общее кратное (НОК):
1) Дана схема реакции и кислорода слева 3, а справа 2:
KClO3 = KCl + O2
2) Находим НОК для 3 и 2 – это 6. Далее делим 6 на 3 и получаем коэффициент слева 2, делим 6 на 2 и получаем коэффициент справа 3:
2KClO3 = KCl + 3O2
3) Доуравниваем калий: слева его 2. Справа ставим также коэффициент 2:
2KClO3 = 2KCl + 3O2
4) Проверяем по хлору: слева 2, справа 2. Реакция уравнена!
3. Подбор через удваивание: если интересующий нас атом встречается в разных формулах одной части реакции.
1) Дана схема реакции, где кислород разбросан по разным молекулам левой части:
CO + O2 = CO2
2) Удвоим кислород в СО, где его меньше:
2CO + O2 = CO2
3) Считаем углерод: слева 2, справа 1. Удвоим углерод справа:
2CO + O2 = 2CO2
4) Считаем кислород: слева 4, справа 4. Реакция уравнена!
Типы реакций в неорганической химии:

Также реакции можно классифицировать:
1. По изменению степени окисления:
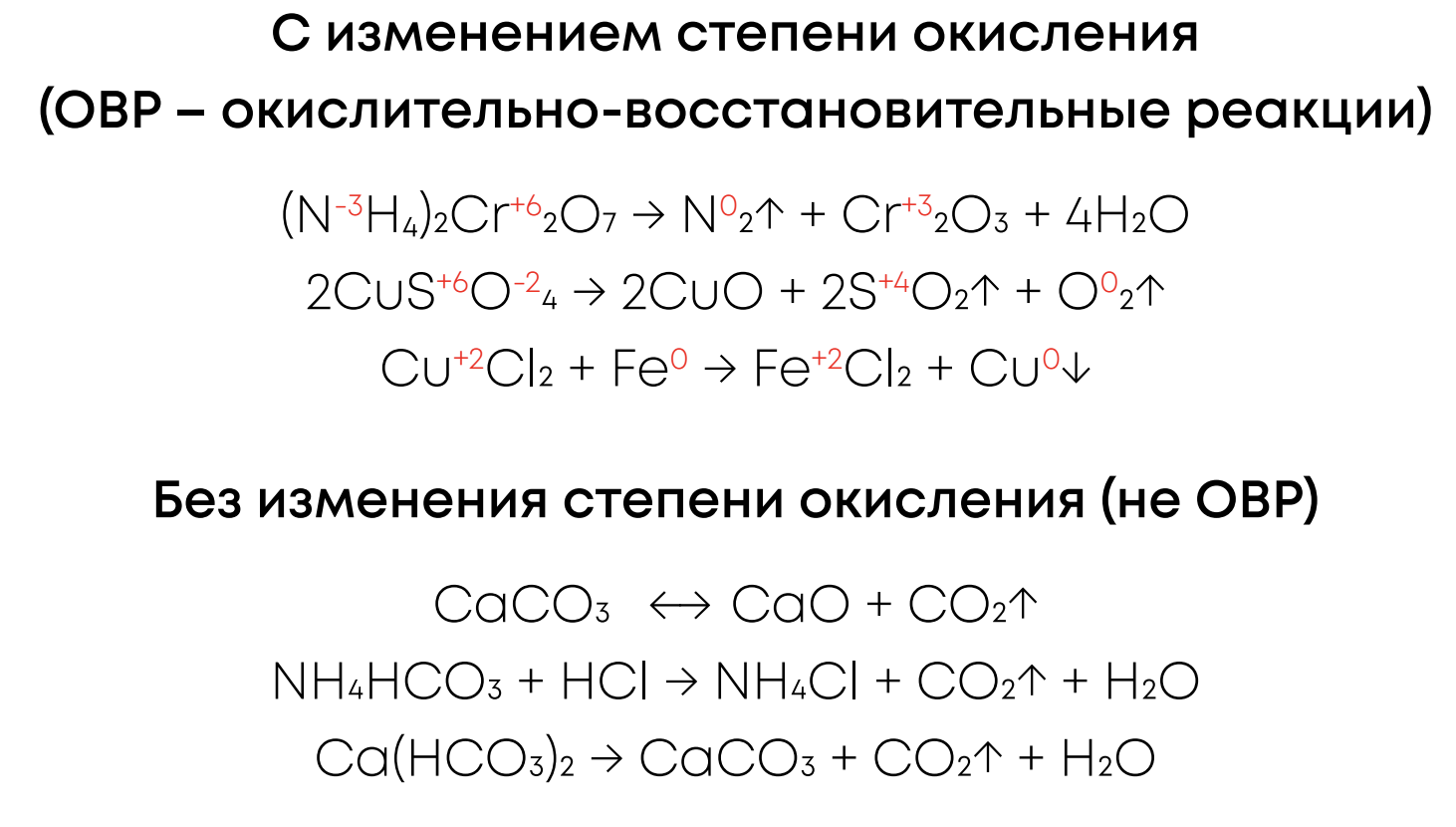
2. По тепловому эффекту реакции:
Экзотермические реакции (с выделением тепла) – большинство реакций соединения-замещения-обмена
Эндотермические реакции (с поглощением тепла) – большинство реакций разложения

3. По однородности:

4. По обратимости:

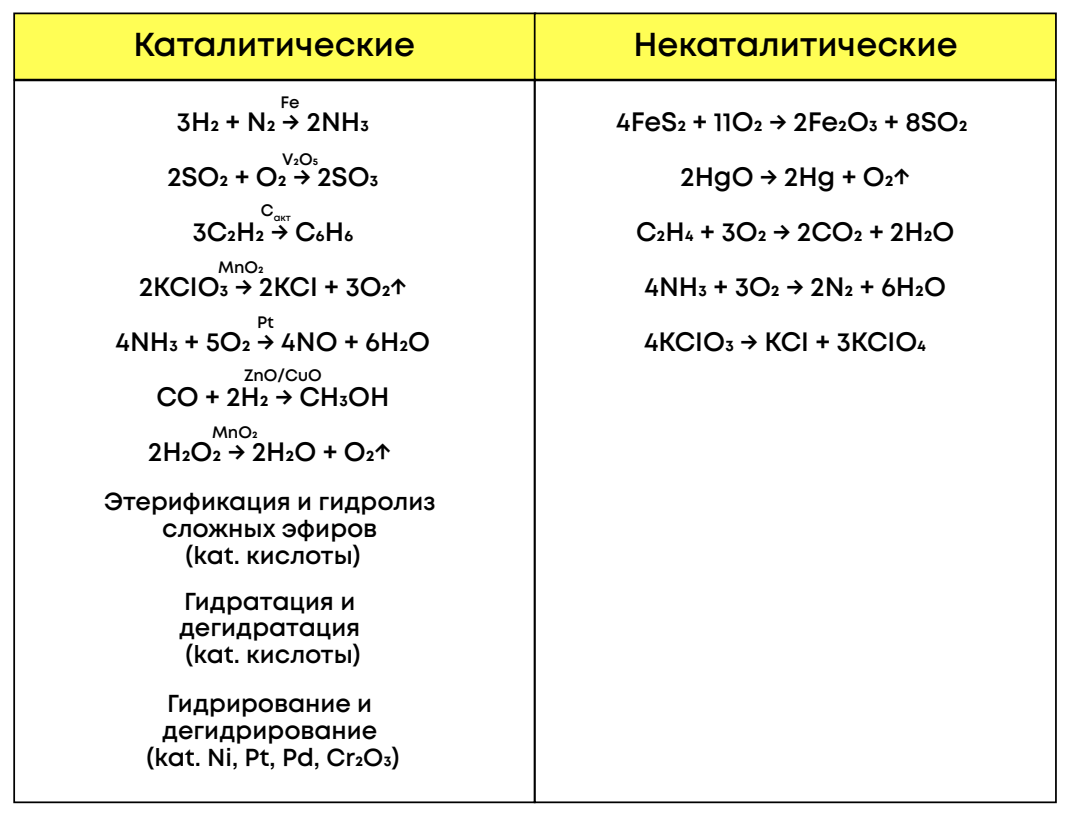
5. По участию катализатора:
Каталитические – идут с участием вещества-катализатора
Некаталитические – идут без участия вещества-катализатора