Большинство элементов в ПСХЭ являются металлами, они образуют простые вещества-металлы, которые занимают важное место в химии и используются человеком в промышленности и строительстве.
Металлы – это простые вещества, образованные элементами-металлами
Для металлов характерна металлическая кристаллическая решётка,
которая придаёт их простым веществам особые физические свойства:

Металлы отличаются друг от друга по химической активности, закономерность изменения которых представлена в электрохимическом ряду напряжений металлов (ряд активности металлов):

- Активные металлы: Li, Rb, K, Ba, Sr, Ca, Na, Mg, Al
- Среднеактивные металлы: Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb
- Малоактивные металлы: Sb, Bi, Cu, Hg, Ag, Pt, Au
- Благородные или инертные металлы: Pt, Au
Общие химические свойства металлов
1. Кислород взаимодействует с металлами (как правило при нагревании), кроме благородных или инертных металлов:
В большинстве случаев образуются оксиды металлов:
Ca + O2 → 2CaO
3Fe + 2O2 → Fe3O4 – до железной окалины (FeO + Fe2O3)
Щелочные металлы взаимодействуют до образования пероксидов или надпероксидов (кроме лития – до оксида):
4Li + O2 → 2Li2O – до оксида (с.о. О равна -2)
2Na + O2 → Na2O2 – до пероксида (с.о. О равна -1)
K + O2 → KO2 – до надпероксида (с.о. О равна -1/2)
Rb + O2 → RbO2 – до надпероксида (с.о. О равна -1/2)
Cs + O2 → CsO2 – до надпероксида (с.о. О равна -1/2)
Щелочноземельные металлы взаимодействуют до оксидов, барий может реагировать и до оксида и до пероксида:
2Ba + O2 → 2BaO
Ba + O2 → BaO2
2. Водород взаимодействует с активными металлами до образования гидридов (с.о. водорода равна -1):
Ba + H2 → BaH2
2Na + H2 → 2NaH
Гидриды реагируют с водой и кислотами:
NaH + H2O → NaOH + H2↑
NaH + HCl → NaCl + H2↑
3. Сера взаимодействует с металлами при нагревании до образования сульфидов (с.о. серы равна -2):
2Na + S → Na2S
Ca + S → CaS
Fe + S → FeS
4. Кремний реагирует при нагревании c активными и среднеактивными металлами до образования силицидов (с.о. кремния обычно равна -4):
2Mg + Si → Mg2Si
Силициды реагируют с водой и кислотами:
Mg2Si + 4H2O → 2Mg(OH)2↓ + SiH4↑
Mg2Si + 4HCl → 2MgCl2 + SiH4↑
5. Углерод реагирует при нагревании c активными и среднеактивными металлами до образования карбидов (с.о. углерода равна -1 или -4, нужно запомнить два примера):
Ca + 2C → CaC2
4Al + 3C → Al4C3
Карбиды реагируют с водой и кислотами до органических ацетилена С2H2 или метана СН4 (зависит от степени окисления углерода в карбиде):
CaC2 + 2H2O → Ca(OH)2↓ + C2H2↑
Al4C3 + 12H2O → 4Al(OH)3↓ + 3CH4↑
CaC2 + 2HCl → CaCl2 + C2H2↑
Al4C3 + 12HCl → 4AlCl3 + 3CH4↑
6. Фосфор реагирует при нагревании c активными и среднеактивными металлами до фосфидов (с.о. фосфора равна -3):
3Ca + 2P → Ca3P2
Фосфиды реагируют с водой и кислотами до образования фосфина PH3:
Ca3P2 + 6H2O → 3Ca(OH)2↓ + 2PH3↑
Ca3P2 + 6HCl → 3CaCl2 + 2PH3↑
7. Азот реагирует при нагревании c активными и среднеактивными (без нагревания только с литием) до образования нитридов (с.о. азота равна -3):
6Na + N2 → 2Na3N
Нитриды реагируют с водой и кислотами:
Na3N + 3H2O → 3NaOH + NH3↑ – до аммиака
Na3N + 4HCl → 3NaCl + NH4Cl – до соли аммония (аммиак основный)
8. Галогены (как правило при нагревании) – фтор со всеми, остальные не реагируют с Au и Pt:
Образуют галогениды – фториды, хлориды, бромиды, иодиды (с.о. -1):
Ca + Cl2 → CaCl2
2K + F2 → 2KF
Mg + I2 → MgI2
2Na + Br2 → 2NaBr
9. Кислоты взаимодействуют с металлами левее водорода в ряду активности:
Металлы замещают водород из кислот, образуются соли:
Mg + H2SO4 (разб.) → MgSO4 + H2↑
Cu + 2HCl → нет реакции
Если металл реагирует с водой без температуры, то идёт конкурирующая реакция с ней, так как реакции идут в растворах
10. Кислоты-окислители взаимодействуют с металлами иначе (к ним относим H2SO4 концентрированную и HNO3 любой концентрации):
С кислотами-окислителями способны реагировать все металлы кроме благородных (Au, Pt). При реакции с ними не выделяется водород, реакция идёт по схеме:
Me + H2SO4 (конц.) → MeSO4 + H2S↑/S↓/SO2↑ + H2O
Me + HNO3 → MeNO3 + NO2↑/NO↑/N2O↑/N2↑/NH4NO3 + H2O
Продукт с серой при реакции с серной кислотой зависит от активности металла, продукт с азотом при реакции с азотной кислотой – от активности металла и степени разбавленности кислоты
11. Взаимодействие с водой:
Активные металлы (от Li до Al) реагируют с водой без нагревания с образованием гидроксида:
2Na + 2H2O → 2NaOH + H2↑
Исключения: магний – только при кипячении, алюминий – при снятии оксидной плёнки
Среднеактивные металлы (после Al до H) реагируют только при нагревании с образованием оксида и водорода:
Zn + H2O → ZnO + H2↑
Малоактивные металлы (правее H) с водой не взаимодействуют
12. Соли взаимодействуют с металлами в растворах и расплавах:
Более активные металлы в ряду активности способны
замещать из солей менее активные:
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag↓
13. Взаимодействие с оксидами протекает при нагревании с замещением менее активного металла из оксида:
2Al + Fe2O3 → 2Fe + Al2O3
Также могут реагировать с оксидами неметаллов:
2Mg + SiO2 → 2MgO + Si
Mg + CO → MgO + C
Cu + N2O → CuO + N2
14. С щелочами реагируют металлы, образующие амфотерные соединения (Be, Zn, Al и др.):
При взаимодействии с раствором щёлочи образуется комплексная соль:
Zn + 2NaOH + 2H2O → Na2[Zn(OH)4] + H2↑ – до тетрагидроксоцинката
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑ – до тетрагидроксоалюмината
При взаимодействии в расплаве образуется средняя соль:
Zn + 2NaOH → Na2ZnO2 + H2↑ – до цинката
2Al + 6NaOH → 2NaAlO2 + 2Na2O + 3H2↑ – до алюмината
Методы получения металлов
Металлы в природе встречаются в основном в виде соединений, лишь самые малоактивные металлы могут встречаться в виде простых веществ. Возникает вопрос: а как получить металл из его соединения – руды? Методами получения металлов путём восстановления из соединений занимается металлургия.

Металлургия – область науки и промышленности, занимающаяся вопросами получения металлов из руд, а также получением сплавов металлов с заданными свойствами
Пирометаллургия – метод получения металлов из соединений при взаимодействии с восстановителем при высокой температуре (подходит для среднеактивных и малоактивных металлов)
1. Карботермия (восстановитель: C, CO) – для металлов правее Al в ряду активности:
FeO + C → Fe + CO
FeO + CO → Fe + CO2
2. Водородотермия (восстановитель: H2) – для металлов правее Al в ряду активности:
CuO + H2 → Cu + H2O
3. Металлотермия (восстановитель: более активный металл)
Fe2O3 + 2Al → Al2O3 + 2Fe – алюмотермия (алюминотермия)
Zn + CuO → ZnO + Cu – цинкотермия
Mg + ZnO → MgO + Zn – магнийтермия
Гидрометаллургия – метод получения металлов из растворов солей замещением более активным металлом (подходит для среднеактивных и малоактивных металлов)
Fe + CuCl2 = FeCl2 + Cu
Электрометаллургия – метод получения металлов с помощью электролиза растворов и расплавов их соединений (подходит для металлов любой активности)
Электролиз расплавов – для активных металлов:
2NaCl → 2Na + Cl2
Электролиз растворов – для средне-/малоактивных:
2CuSO4 + 2H2O → 2Cu + O2 + 2H2SO4
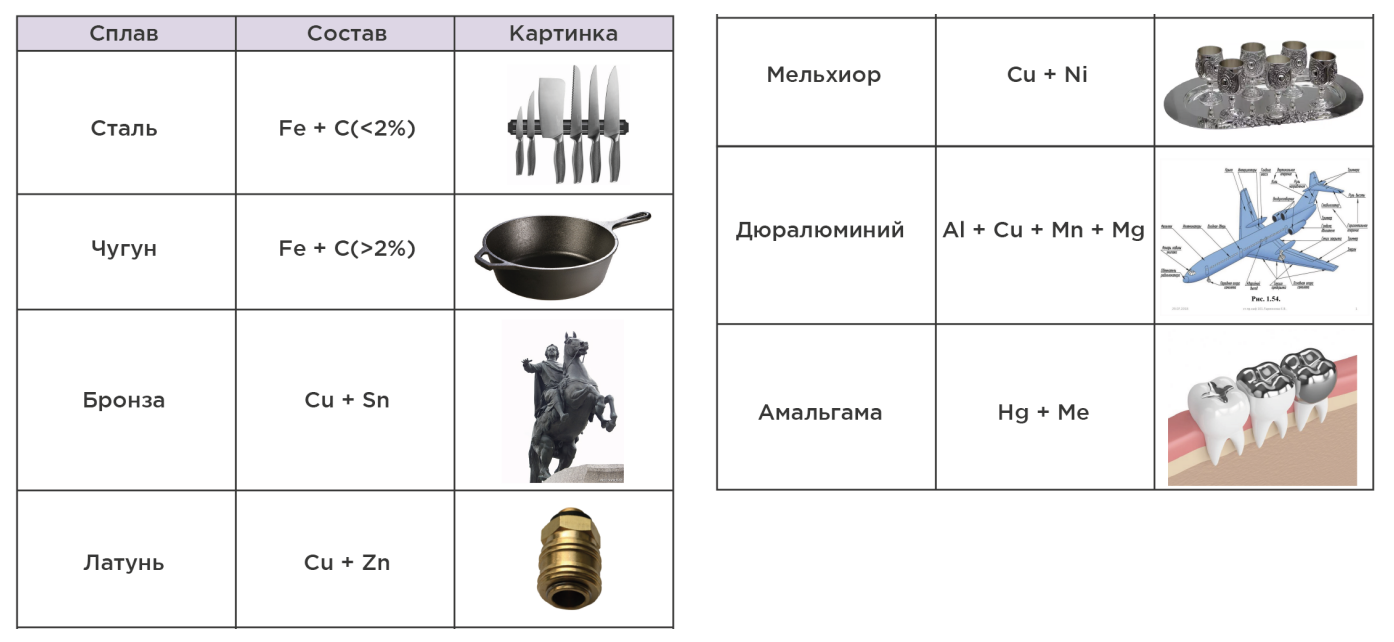
Сплавы металлов – однородные смеси из нескольких компонентов с преобладанием металлических
Легированный сплав – сплав с добавлением небольшого количества дополнительных компонентов, дающих определённые свойства: термостойкость, коррозионную стойкость, кислотоупорность и др.
Схема получения чугуна и стали
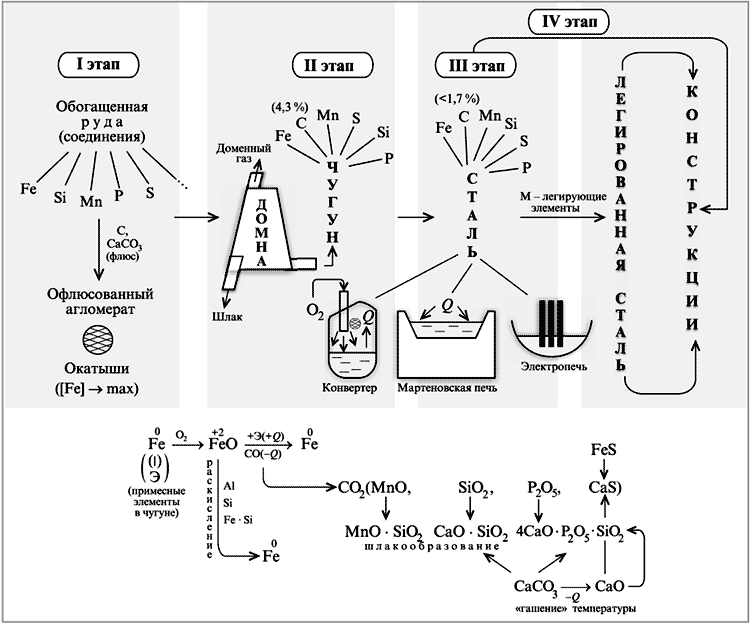
Чугун получают в доменной печи при высокой температуре в доменной печи путём восстановления железа из оксидов в руде с помощью кокса С. В чугуне содержание углерода более 2% из-за чего сплав обладает хрупкостью.
Чтобы получить из чугуна сталь, где содержание углерода меньше, используют мартеновскую печь, конвертер или электропечь. Полученная сталь с низким содержанием углерода обладает высокой пластичностью.