Углерод – элемент IVA группы 2 периода ПСХЭ. Характерны степени окисления в промежутке от -4 до +4, но чаще всего -4, 0, +2, +4.
Для углерода характерна аллотропия, т.е. у элемента существует много простых веществ:
Кристаллические формы: графит, алмаз, фуллерен, карбин, углеродные нанотрубки и др.
Аморфные формы (содержат примеси): активированный уголь, кокс, древесный уголь, каменный уголь, сажа и др.
Сравнение физических свойств основных аллотропных форм:
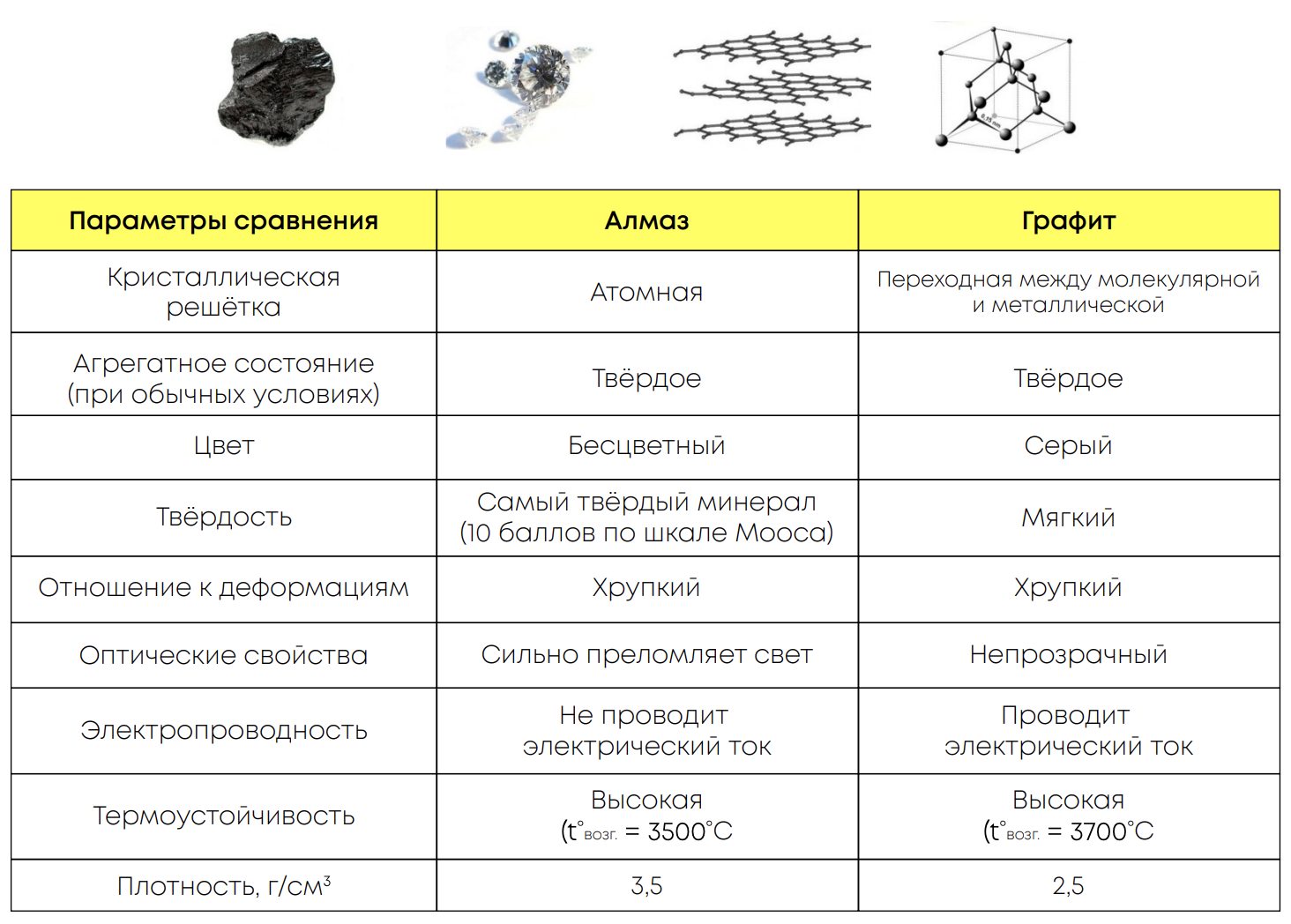
В природе углерод встречается в виде простых веществ (алмаз, графит) и в виде органических соединений (белки, жиры, углеводы, соединения нефти/природного газа/каменного угля и др.).
Получение:
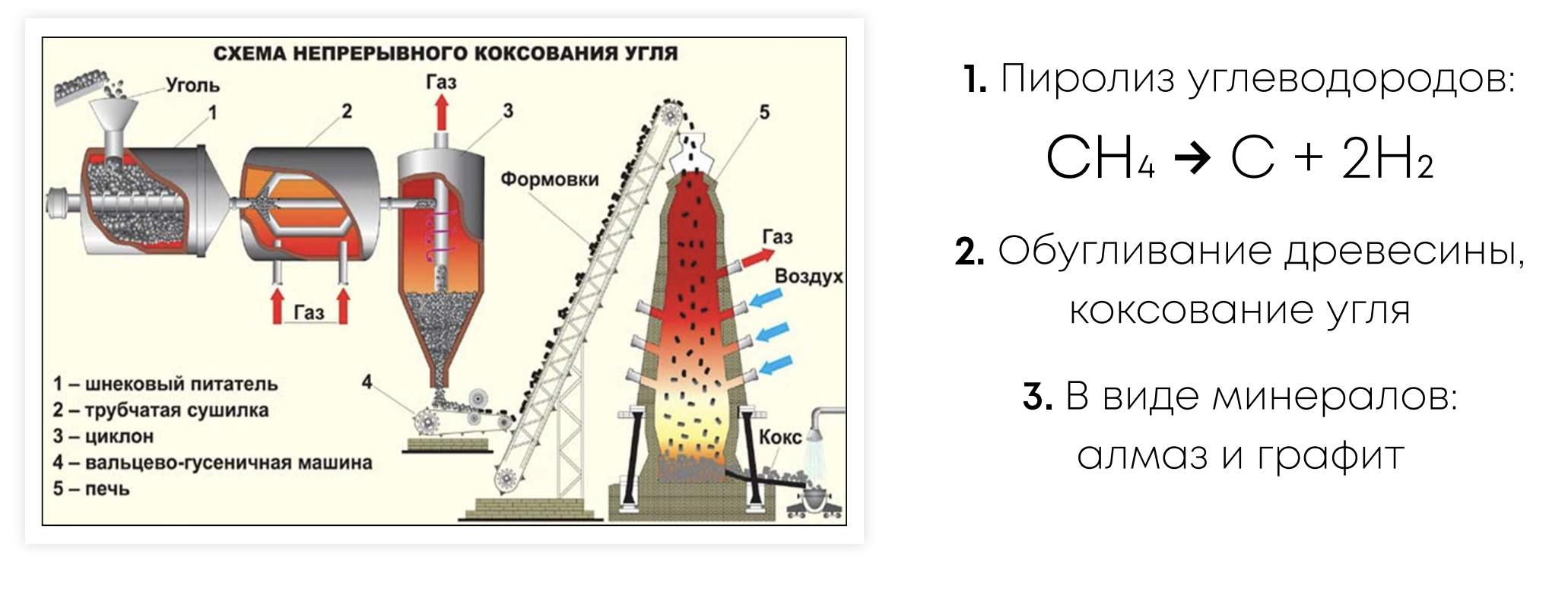
Химические свойства:
Самая реакционно способная форма углерода – аморфный углерод и графит, алмаз достаточно инертен и очень тяжело вступает в реакции.
1. Взаимодействие с металлами (активными и среднеактивными):
Углерод образует карбиды (с.о. -1 или -4):
Ca + 2C → CaC2
4Al + 3C → Al4C3
2. Взаимодействие с неметаллами:
Углерод при нагреве реагирует с кислородом, водородом, фтором, серой, кремнием:
2C + O2 → 2CO – недостаток кислорода до угарного газа
C + O2 → CO2 – избыток кислорода до углекислого газа
C + 2H2 → CH4
С + 2F2 → CF4
2S + C → CS2
Si + C → SiC
3. Взаимодействие с оксидами:
Углерод и угарный газ при нагревании восстанавливают металлы (правее алюминия в ряду активности) – карботермия:
C + FeO → Fe + CO
CO + CuO → Cu + CO2
CaO + 3C → CaC2 + CO – взаимодействие с оксидами активных металлов
4. При нагревании возможна реакция с водяным паром:
C + H2O → CO + H2
5. Углерод реагирует с кислотами-окислителями:
C + 2H2SO4 (конц.) → CO2↑ + 2SO2↑ + 2H2O
C + 4HNO3 (конц.) → CO2↑ + 4NO2↑ + 2H2O
3C + 4HNO3 (разб.) → 3CO2↑ + 4NO↑ + 2H2O
Применение: графит – электроды, карандаши, смазка; алмаз – ювелирные
украшения, стеклорезы, шлифовка; активированный уголь как абсорбент в медицине и в фильтрах; кокс в металлургии для получения стали и чугуна

Кремний – элемент IVA группы 3 периода ПСХЭ. Характерны степени окисления в промежутке от -4 до +4, но чаще всего -4, 0, +2, +4.
Формы кремния:

В природе кремний является вторым по распространённости химическим элементом, образует огромное количество минералов: кремнезём, кварц, агат, яшма, опал и др. В основном минералы образованы оксидом кремния SiO2.
Получение:
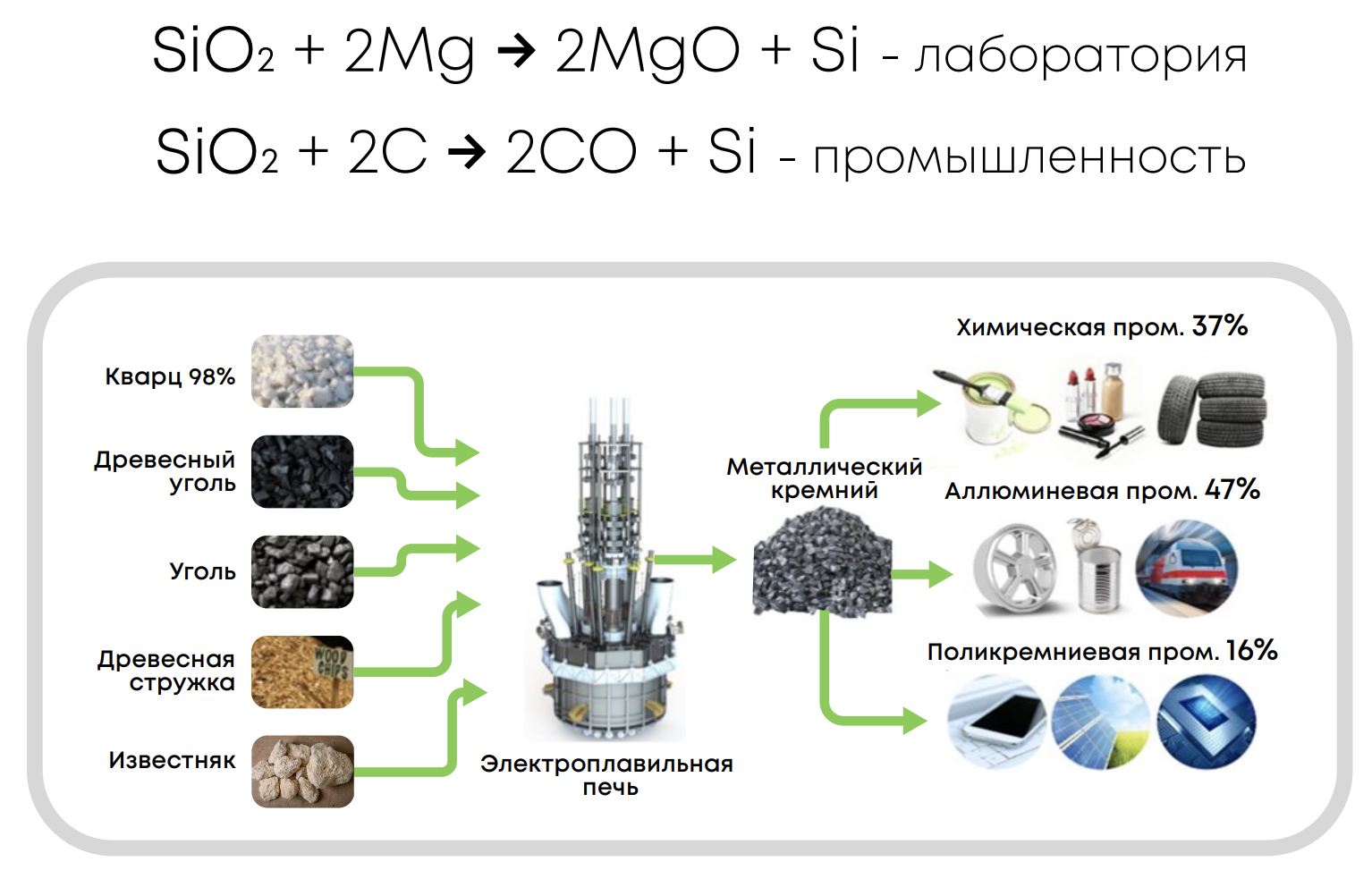
Химические свойства:
1. Взаимодействует с активными и среднеактивными металлами при нагревании:
Кремний образует силициды (с.о. как правило -4):
2Mg + Si → Mg2Si
Силициды реагируют с водой и кислотами:
Mg2Si + 4H2O → 2Mg(OH)2↓ + SiH4↑
Mg2Si + 4HCl → 2MgCl2 + SiH4↑
2. Взаимодействие с неметаллами:
Кремний при нагреве реагирует с кислородом, галогенами, азотом, углеродом:
Si + O2 → SiO2
Si + 2Hal2 → SiHal4
Si + С → SiС
3. При нагревании кремний также способен реагировать с оксидами металлов и неметаллов:
Si + MnO2 → SiO2 + Mn
SiO2 + Si → 2SiO
4. При нагревании возможна реакция с водяным паром:
Si + 2H2O → SiO2 + 2H2
5. Кремний вступает при нагревании в реакцию с щелочами:
Si + 2NaOH + H2O → Na2SiO3 + 2H2↑
6. С кислотами:
Кремний вступает в реакцию замещения с газообразными галогеноводородами:
Si + 4HHal → SiHal4 + 2H2
Также способен вступать в реакцию с плавиковой кислотой:
Si + 6HF → H2[SiF6] + 2H2↑
Применение: солнечные батареи; добавка к сплавам; в электронике как полупроводник

