Генетическая связь между классами соединений это связь, отвечающая на вопросы:
1. Как связаны различные классы веществ?
2. Каким образом из одного класса можно получить другой?
3. Какие общие химические реакции характерны для класса?
Таблица общих взаимосвязей:
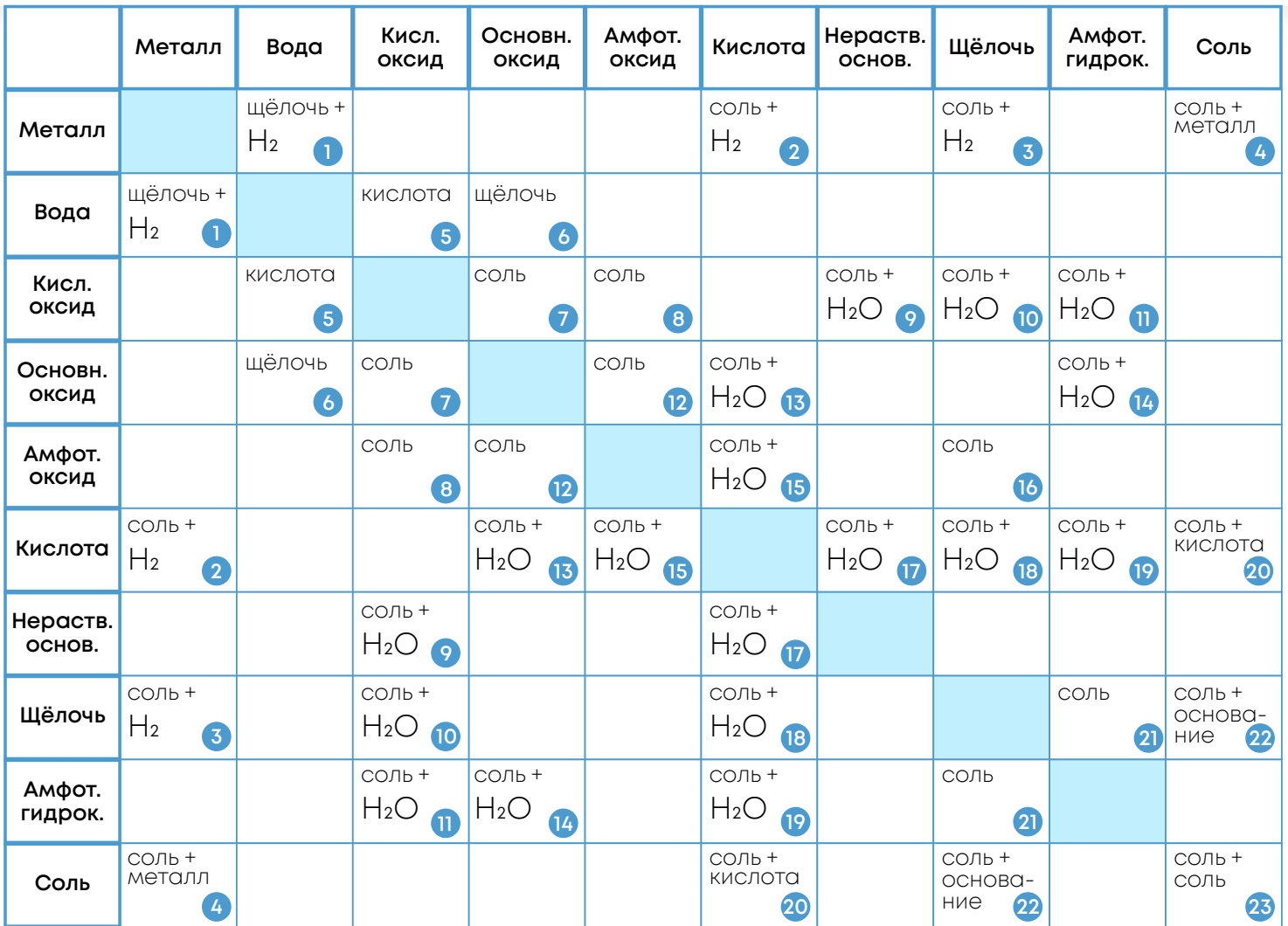
Примеры химических реакций:
1. Металл + вода → гидроксид + водород*
2Na + 2H2O → 2NaOH + H2↑
* среднеактивные металлы – до оксида, а малоактивные – не реагируют
2. Металл + кислота → соль + водород*
Mg + 2HCl → MgCl2 + H2↑
*реагируют металлы до водорода; кислоты-окислители реагируют иначе
3. Металл + щёлочь → соль + водород*
Zn + 2NaOH → Na2ZnO2 + H2↑
Zn + 2NaOH + 2H2O → Na2[Zn(OH)4] + 2H2↑
* с щелочами реагируют только амфотерные металлы, реакции при сплавлении и в растворе протекают по-разному
4. Металл + соль → соль + металл*
Zn + CuCl2 → ZnCl2 + Cu↓
* вытеснение активным металлом менее активного в растворе
5. Вода + кислотный оксид → кислота*
SO3 + H2O → H2SO4
*диоксид кремния не реагирует
6. Вода + основный оксид → щёлочь*
BaO + H2O → Ba(OH)2
*реагируют только оксиды активных металлов
7. Кислотный оксид + основный оксид → соль*
Na2O + SO3 → Na2SO4
*хотя бы один оксид должен соответствовать сильному электролиту
8. Кислотный оксид + амфотерный оксид → соль*
ZnO + SO3 → ZnSO4
*только кислотные оксиды, соответствующие сильным кислотам
9. Кислотный оксид + нерастворимое основание → соль + вода*
Cu(OH)2 + SO3 → CuSO4 + H2O
*только кислотные оксиды, соответствующие сильным кислотам,
может получится не только средняя соль
10. Кислотный оксид + щёлочь → соль + вода*
2NaOH + CO2 → Na2CO3 + H2O
*может получится не только средняя соль
11. Кислотный оксид + амфотерный гидроксид → соль + вода*
Zn(OH)2 + SO3 → ZnSO4 + H2O
*только кислотные оксиды, соответствующие сильным кислотам,
может получится не только средняя соль
12. Основный оксид + амфотерный оксид → соль*
Na2O + ZnO → Na2ZnO2
*только основные оксиды, соответствующие щелочам
13. Основный оксид + кислота → соль + вода*
K2O + 2HCl → 2KCl + H2O
*неактивные основные оксиды не реагируют с слабыми кислотами
14. Основный оксид + амфотерный гидроксид → соль + вода*
Na2O + Zn(OH)2 → Na2ZnO2 + H2O
* только основные оксиды, соответствующие щелочам
15. Амфотерный оксид + кислота → соль + вода*
ZnO + 2HCl → ZnCl2 + H2O
*реагируют только сильные кислоты
16. Амфотерный оксид + щёлочь → соль*
2NaOH + ZnO → Na2ZnO2 + H2O
2NaOH + ZnO + H2O → Na2[Zn(OH)4]
*реакции по-разному протекают в растворе и в расплаве
17. Кислота + нерастворимое основание → соль + вода*
H2SO4 + Cu(OH)2 → CuSO4 + 2H2O
*реагируют только сильные кислоты
18. Кислота + щёлочь → соль + вода*
HCl + KOH → KCl + H2O
*могут получаться не только средние соли
19. Кислота + амфотерный гидроксид → соль + вода*
Be(OH)2 + 2HCl → BeCl2 + 2H2O
* реагируют только сильные кислоты
20. Кислота + соль → соль + кислота*
NaNO2 + HCl → HNO2 + NaCl
*должен быть признак реакции ионного обмена
21. Щелочь + амфотерный гидроксид → соль*
2NaOH + Be(OH)2 → Na2BeO2 + 2H2O
2NaOH + Be(OH)2 → Na2[Be(OH)4]
*реакции протекают по разному при сплавлении и в растворе
22. Щелочь + соль → соль + основание*
2NaOH + CuCl2 → Cu(OH)2↓ + 2NaCl
*условия реакции: оба реагенты растворимы и есть признак реакции ионного обмена
23. Соль + соль → соль + соль*
Na2CO3 + CaCl2 → CaCO3↓ + 2NaCl
*условия реакции: оба реагенты растворимы и есть признак реакции ионного обмена
