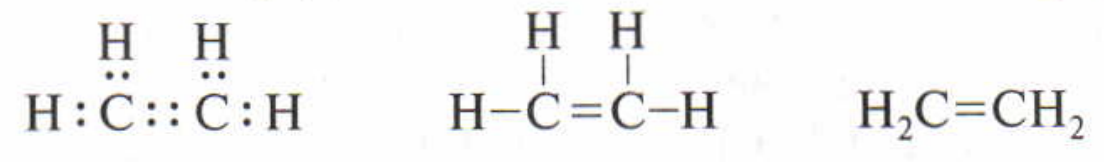Углеводороды – простейшие по составу органические вещества, состоящие из двух элементов: углерода и водорода
Предельные (насыщенные) углеводороды или алканы/парафины – это углеводороды, все атомы углерода в молекуле которых соединены одинарной связью и нет двойных-тройных связей из-за чего невозможно присоединение к их молекулам
Состав и молекулярные формулы алканов соответствуют формуле CnH2n+2, где n – количество атомов углерода: метан CH4, этан С2Н6, пропан C3H8, бутан C4H10 и т.д.
Простейшие представители класса (метан, этан, пропан, бутан) являются бесцветными газами при н.у., алканы с 5 атомов углерода представляют собой легкокипящие жидкости с запахом бензина, а представители с 17 атомов углерода – твёрдые белые вещества жирные на ощупь. Алканы малорастворимы в воде из-за неполярности молекул.

Алканы в природе содержатся в нефти и природном газе. Простейший представитель, который является основным компонентом природного газа – метан образуется в природе в результате разложение органических остатков растений и животных без доступа воздуха, что объясняет выделение пузырьков газа из болот (из-за этого метан называют болотным газом). Также выделяется из каменноугольных пластов и накапливается в шахтах, поэтому другое название метана – рудничный газ.
Химические свойства
При обычных условиях алканы малоактивны и вступают в реакции в жёстких условиях. Для алканов наиболее характерны реакции замещения из-за предельности.
1. Вступают в реакции замещения водорода с галогенами при нагревании или облучении до образования галогенпроизводных:

2. Нитрование (реакция Коновалова) – с разбавленной HNO3 при P и t в алканах водород замещается на нитрогруппу до образования нитросоединений:
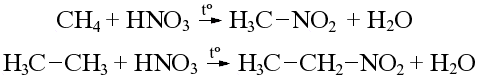
3. Пиролиз – разложение при высокой t без доступа воздуха:
СН4 → С + 2Н2 – просто пиролиз
2СН4 → СН≡СН + 3Н2 – пиролиз с резким охлаждением до ацетилена
4. Как и все углеводороды горят до образования углекислого газа (для старта реакции необходима температура):
СН4 + 2О2 → СО2 + 2Н2О
Смесь газообразных алканов с воздухом взрывоопасна, такие смеси могут образовываться на шахтах, котельных и т.д.
5. Дегидрирование – отщепление Н2 до образования непредельных соединений при t, кат.: Pt, Ni, Pd
В отличие от непредельных соединений не обесцвечивают раствор брома в воде (бромная вода) и раствор перманганата калия (марганцовка).
Применение: в основном алканы используются как топливо для получения энергии, а также для получения водорода и кокса, ацетилена, этилена, уксусной кислоты, метанола, галогенпроизводных и др.
Непредельные (ненасыщенные) углеводороды – это углеводороды, в молекуле которых есть двойные-тройные связи между углеродами из-за чего возможны реакции присоединения к их молекулам (двойные связи разрываются до одинарных, а тройные – до двойных или одинарных и у углеродов появляются свободные связи)
Простейшие представители непредельных углеводородов – это алкены и алкины.
Алкены (олефины, этиленовые углеводороды) – это непредельные углеводороды, в молекуле которых есть одна двойная связь между углеродами
Алкены имеют общую формулу CnH2n, где n – количество атомов углерода: этен или этилен С2Н4, пропен или пропилен C3H6 и т.д. То есть меняем суффикс -ан в названиях соответствующих алканов на -ен или -илен.
Нерастворимы в воде, как и все углеводороды, растворимы в неполярных растворителях: С2-С4 – газы, С5-С17 – жидкости, С18≥ – твёрдые вещества.
Химические свойства:
В отличие от алканов, алкены гораздо более реакционноспособны и вступают в реакции присоединения из-за наличия двойной связи.
1. Галогенирование – присоединение галогена:
Качественная реакция – обесцвечивание коричневой бромной воды (раствор брома в воде).
2. Также характерны другие реакции присоединения:
Гидратация – присоединение воды:
Гидрирование – присоединение водорода:
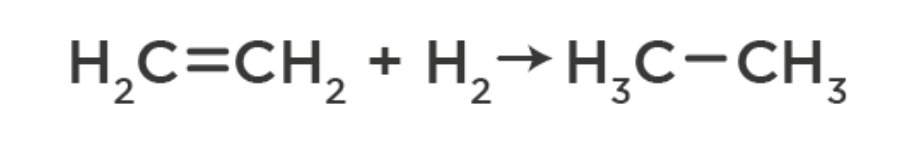
Гидрогалогенирование – присоединение гидрогалогена:
Полимеризация – присоединение молекул друг к другу:
Крупные молекулы полимеров образуются из одинаковых звеньев, повторяющихся огромное количество раз (n – степень полимеризации может принимать значение до десятков тысяч). Полимер полиэтилен представляет собой пластмассу, которая применяется в изготовлении упаковки, труб, посуду, корпуса для техники и т.д.
3. Алкены, как и алканы, горят на воздухе до углекислого газа:

4. Качественная реакция на алкены – обесцвечивание раствора перманганата калия в результате окисления двойной связи:
Применение: получение полимеров-пластмасс, этилен ускоряет созревание плодов овощей и фруктов, получение спирта и других веществ.
Алкины (ацетиленовые углеводороды) – это непредельные углеводороды, в молекуле которых есть одна тройная связь между углеродами
Алкины имеют общую формулу CnH2n-2, где n – количество атомов углерода: этин или ацетилен С2Н2, пропин C3H4 и т.д. То есть меняем суффикс -ан в названиях соответствующих алканов на -ин.
Плохорастворимы в воде, как и все углеводороды, растворимы в неполярных растворителях: С2-С4 – газы, С5-С17 – жидкости, С17≥ – твёрдые вещества.
Химические свойства:
Также как и для алкенов характерны реакции присоединения. В отличие от алкенов реакции присоединения идут в два этапа: разрыв тройной связи до двойной, разрыв двойной связи до одинарной.
1. Могут вступать в реакции присоединения:
Галогенирование (обесцвечивание бромной воды – качественная):

Гидрирование – присоединение водорода:

Гидрогалогенирование – присоединение гидрогалогена:

Также могут присоединять воду – гидратация и присоединяться к своим молекулам – полимеризация, но она протекает хуже чем у алкенов.
2. Горят на воздухе до углекислого газа:
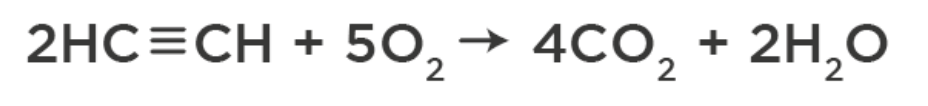
3. Качественная реакция на алкины – обесцвечивание раствора перманганата калия в результате окисления тройной связи:
Применение: ацетилен используют как топливо при сварке-резке металлов и для получения других органических веществ.
Спирты – это производные углеводородов, содержащие гидроксильную группу -ОН
Спирты с одной гидроксильной группой называют одноатомными, а с несколькими – многоатомными. Традиционно названия спиртов образуются из названий соответствующих углеводородов с добавлением суффикса -ол или -иловый спирт. Метан CH4 при замене водорода на -ОН даёт СН3OH – метанол или метиловый спирт.

Физические свойства: С1-С11 – жидкости а с С12≥ – твёрдые вещества; метанол, этанол, пропанол – алкогольный запах, остальные имеют неприятный удушливый запах; хорошо растворимы в воде и сами хорошие растворители; метанол крайне токсичен, этанол обладает наркотическим действием (частое употребление приводит к алкоголизму)
Глицерин (пропандиол-1,2,3) – многоатомный спирт, бесцветная сиропообразная жидкость, сладковатая на вкус, хорошо растворимая в воде:
Химические свойства:
1. Могут вступать в реакцию замещения с активными металлами – образуются соли спиртов (алкоголяты):
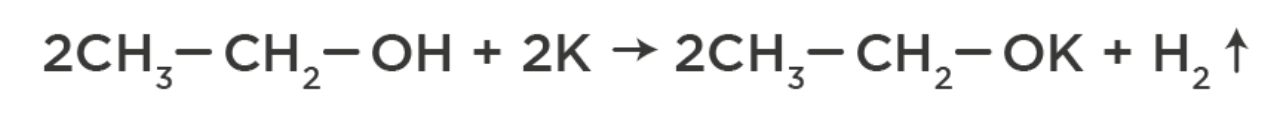
2. Этерификация – образование сложного эфира при реакции с кислотами
при t, кат. кислоты:

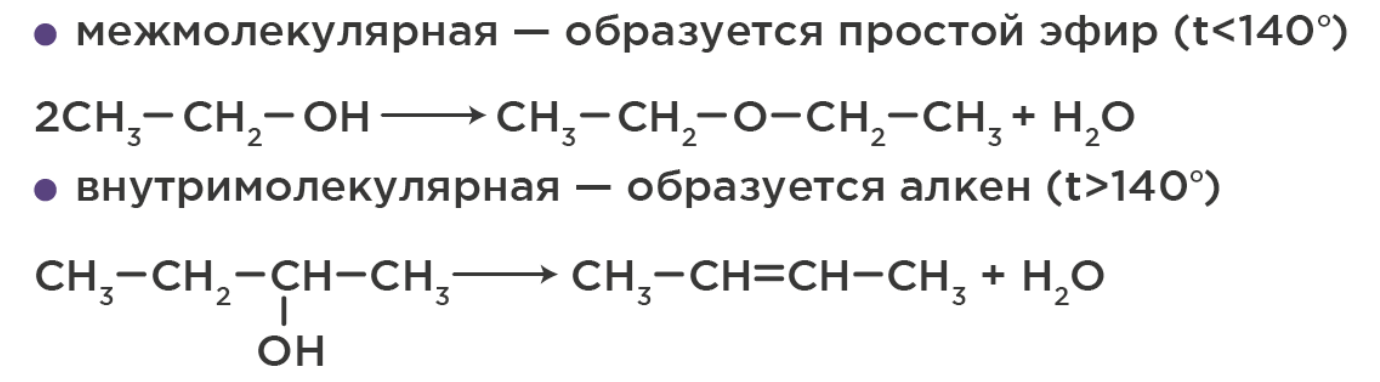
3. Дегидратация – отщепление воды в присутствии серной/фосфорной кислоты и нагревании:
4. Горение – метиловый спирт бесцветным пламенем, а этиловый голубым:
2СН3OH + 3O2 → 2CO2 + 4H2O
5. Качественные реакции на спирты:
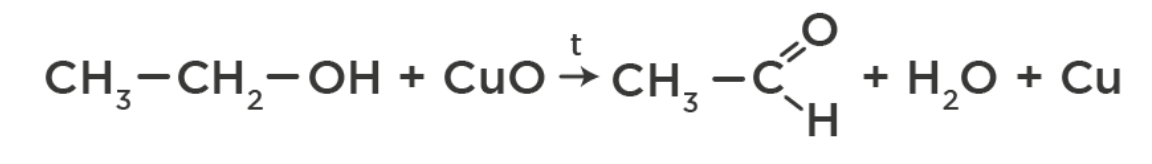
Одноатомные взаимодействуют с CuO при t до альдегидов/кетонов, наблюдается изменение цвета с черного оксида до красноватой меди:
Многоатомные образуют синий раствор комплекса при реакции со свежеосаждённым гидроксидом меди (II):
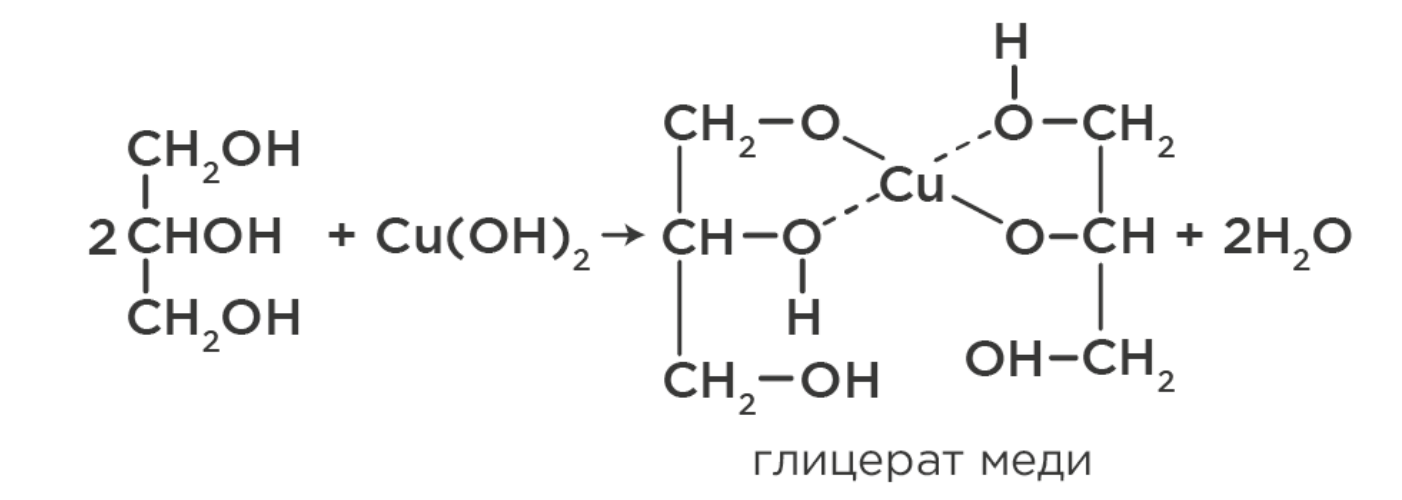
Применение: дезинфекция в медицине (этанол), производство алкоголя (этанол), растворители, производство нитроглицерина (динамит), косметики, подсластитель (глицерин) и др.
Карбоновые кислоты – производные углеводородов, содержащие карбоксильную группу (-COOH)
Уксусная или этановая кислота:
Физические свойства: уксусная кислота при н.у. представляет собой бесцветную жидкость с резким запахом, смешивается с водой в любых пропорциях, 3-9% раствор (уксус) применяется на кухне как приправа, 70-80% раствор называется уксусной эссенцией
Химические свойства:
Карбоксильная группа даёт кислотам кислотные свойства, поэтому карбоновые кислоты проявляют свойства, сходные с слабыми неорганическими кислотами.
1. В водных растворах диссоциируют и дают кислую среду (окрашивают индикаторы):

2. Вступает в типичные реакции кислот с металлами, солями, оксидами, основаниями и образует соли – ацетаты:

![]()
![]()
![]()
3. Со спиртами – этерификация до образования сложных эфиров с фруктово-цветочными запахами (при температуре в кислой среде):

4. Горение:
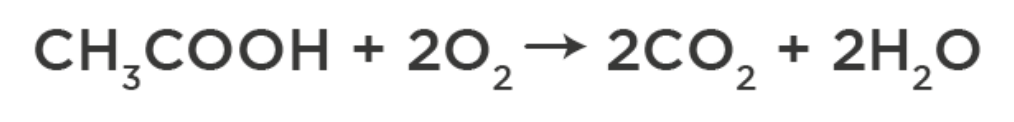
Применение: уксусная кислота используется как консервант и приправа и для получения полимеров, лекарств, искусственного волокна и т.д.
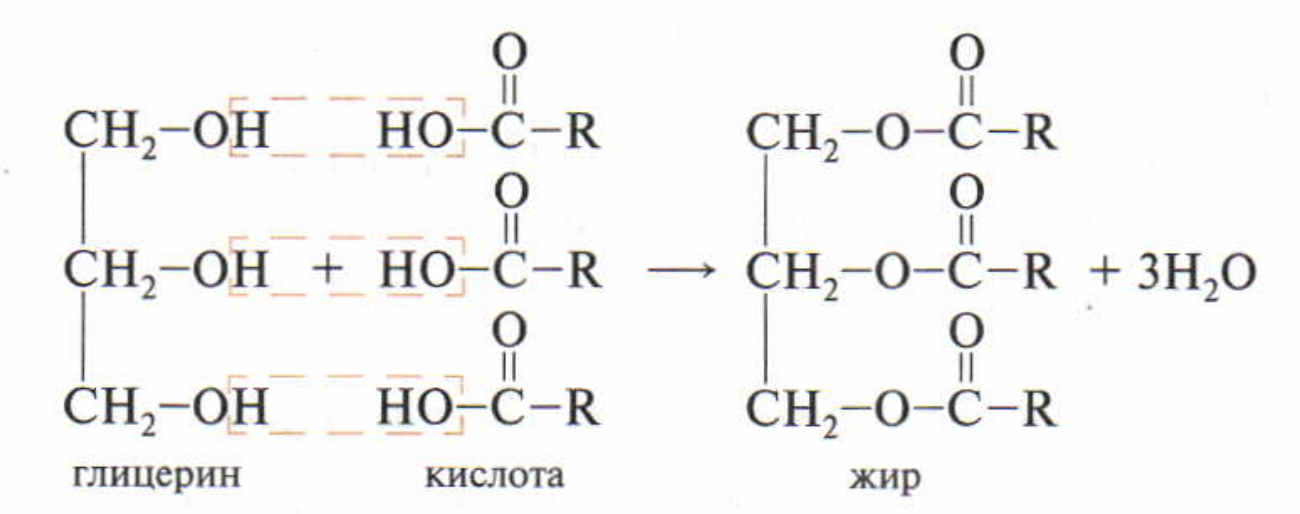
Жиры – сложные эфиры трёхатомного спирта глицерина и жирных кислот (высших карбоновых кислот)
Физические свойства: жиры нерастворимы в воде, растворимы в органических неполярных растворителях (хлороформ, бензин), легче воды
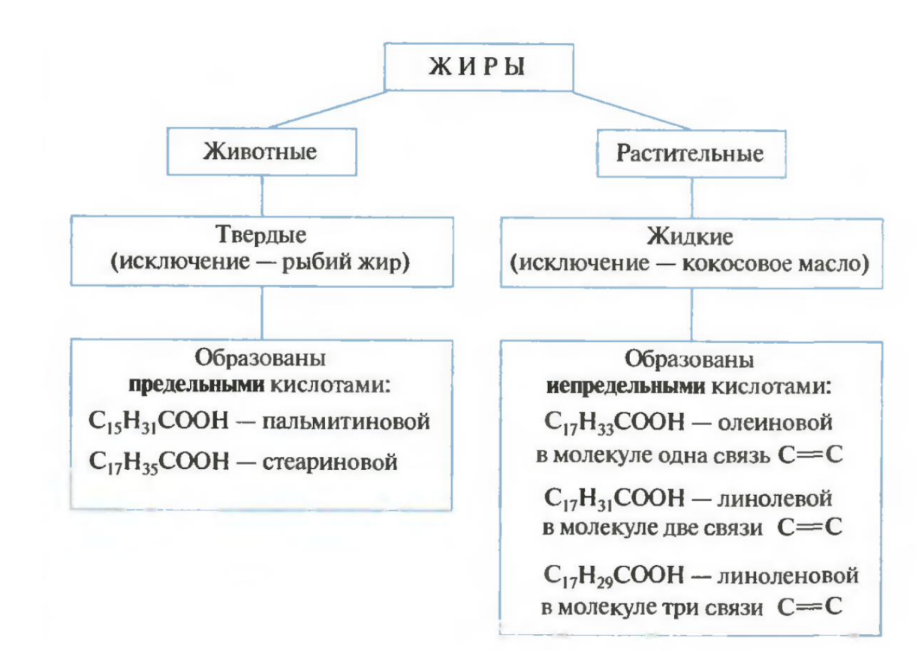
Химические свойства: горят, могут вступать в гидролиз до глицерина и карбоновых кислот, также характерен щелочной гидролиз или омыление
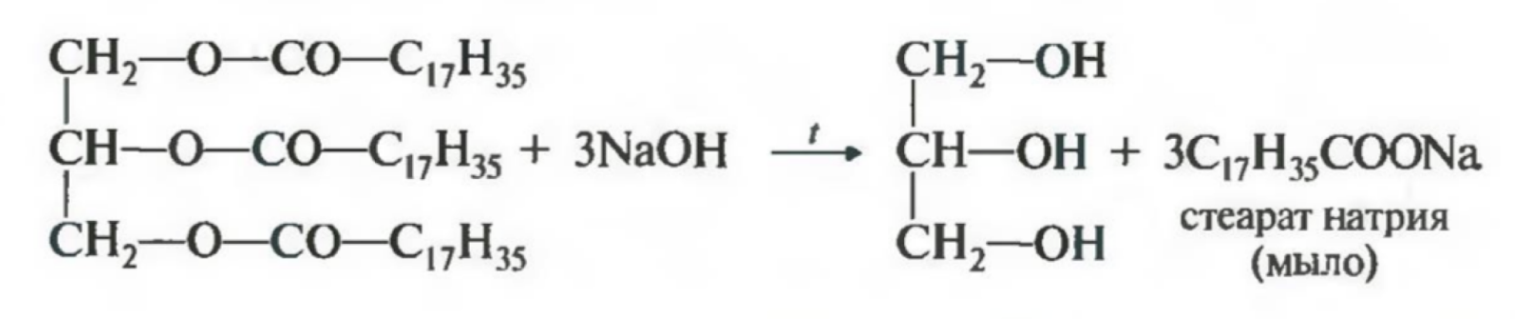
Применение: играют важную биологическую роль и входят в состав животных и растительных организмов, служат источником энергии в пище, из них получают разные вещества (глицерин, карбоновые кислоты, мыло, краски и т.д.)
Углеводы или сахара – природные органические вещества, состав большинства соответствует формуле Cn(H2O)m
Состав большинства углеводов выглядит так, будто соединения состоят из углерода и воды, отсюда и название соединений. При разложении углеводы дают образование черного углерода и пары воды. Образуются в природе в растениях в процессе фотосинтеза:

Моносахариды – простейшие углеводы, к ним относятся фруктоза и глюкоза с формулой С6H12O6, имеющие один состав и разное строение. Представляют собой белые кристаллические вещества, сладкие, растворимые в воде. Содержатся в мёде и фруктах, являются источником энергии для человека при окислении в тканях до воды и углекислого газа. Применяется в медицине и пищевой промышленности.
Дисахариды – сахара, представляющие собой димеры – соединения из двух остатков моносахаридов. К примеру сахароза С12H22O11 – свеколичный или тростниковый сахар, который применяется в качестве продукта питания и в пищевой промышленности.
Полисахариды – сложные углеводы, которые являются полимерами из остатков моносахаридов. Полисахариды не имеют сладкого вкуса, нерастворимы в воде. К ним относятся крахмал, гликоген и целлюлоза, состоящие из остатков глюкозы.
Крахмал – белый порошок, нерастворимый в холодной воде, в горячей образует клейстер. Качественная реакция – образование синей окраски при взаимодействии с иодом. Используется в пищевой промышленности, содержится в хлебе, муке, картофеле. Является запасным веществом растений.
Целлюлоза (клетчатка) – волокнистое вещество, применяется в животноводстве (сено), в организме человека не перевариается. Также применяется в строительстве (древесина), изготовлении тканей (хлопок, лён), бумаги, картона, получении этилового спирта и глюкозы, ацетатного волокна (искусственный шёлк).
Гликоген – полисахарид, являющийся запасным веществом для животных и хранится в печени и мышцах.
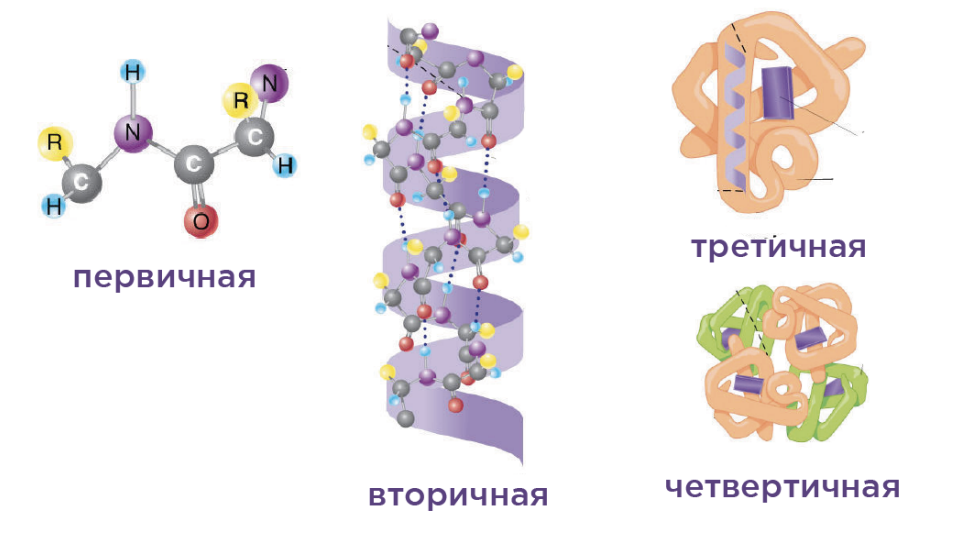
Белки (протеины) – это природные полимеры, образующиеся из остатков аминокислот, связанных пептидными связями
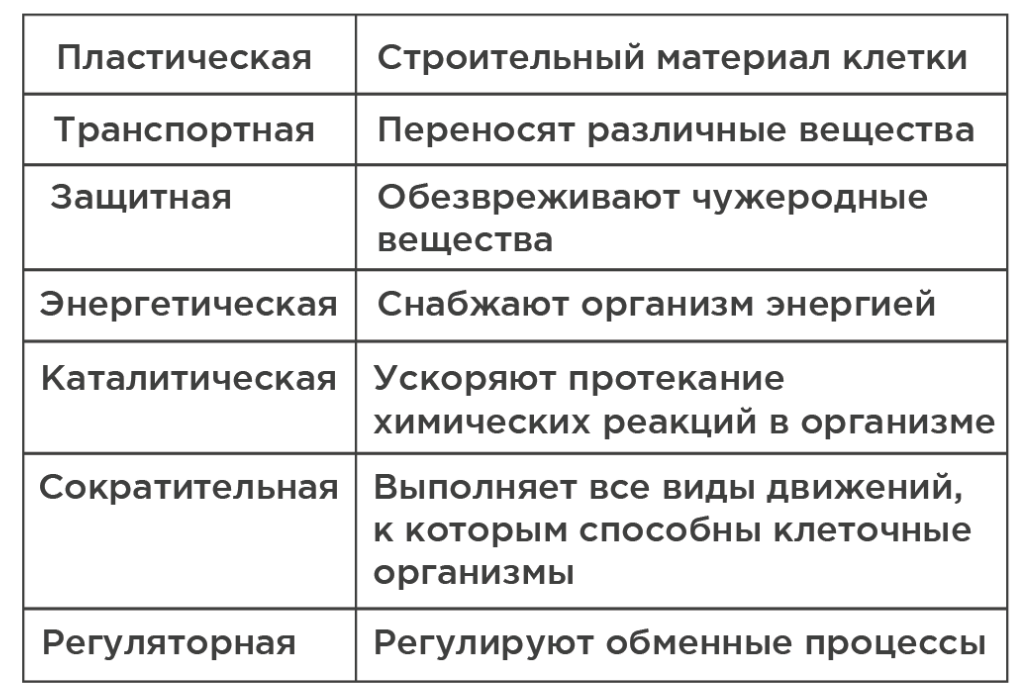
Белки являются самыми важными веществами в организмах. В состав белков входит около 20 аминокислот, которые комбинируются в различной форме и образуют уникальные белки с уникальными свойствами, выполняющие определённую роль в организме.
Структуры белка:

Роль белков в организме:
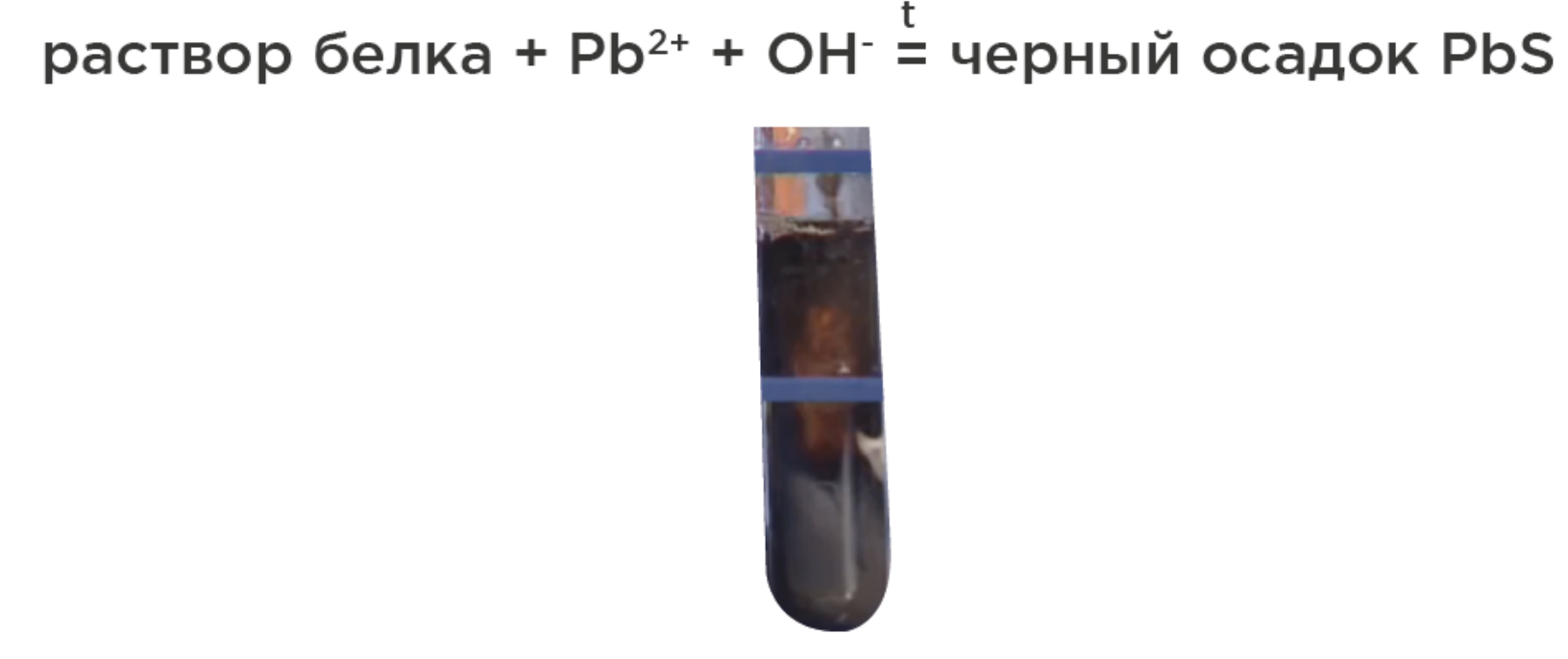
Качественные реакции на белки:
Биуретовая реакция – на пептидную связь:

Ксантопротеиновая – на остатки ароматических аминокислот:

Цистеиновая – на остатки аминокислот с серой:
Применение: белки – не только питательные вещества и важные вещества в организмах, но и сырьё для промышленности: шерсть для тканей, изготовление одежды и обуви из кожи, желатин используется в пищевой промышленности и т.д.