Часто ученики путают валентность со степенью окисления и думают, что они всегда равны. Но это заблуждение! В прошлой главе мы с вами сказали, что валентность – это количество связей, которые может образовывать атом химического элемента. Так что же такое степень окисления?
Степень окисления – это условный заряд, который приобретают атомы в молекуле или кристалле из-за приобретения/отдачи электронов, если считать все полярные связи ионными
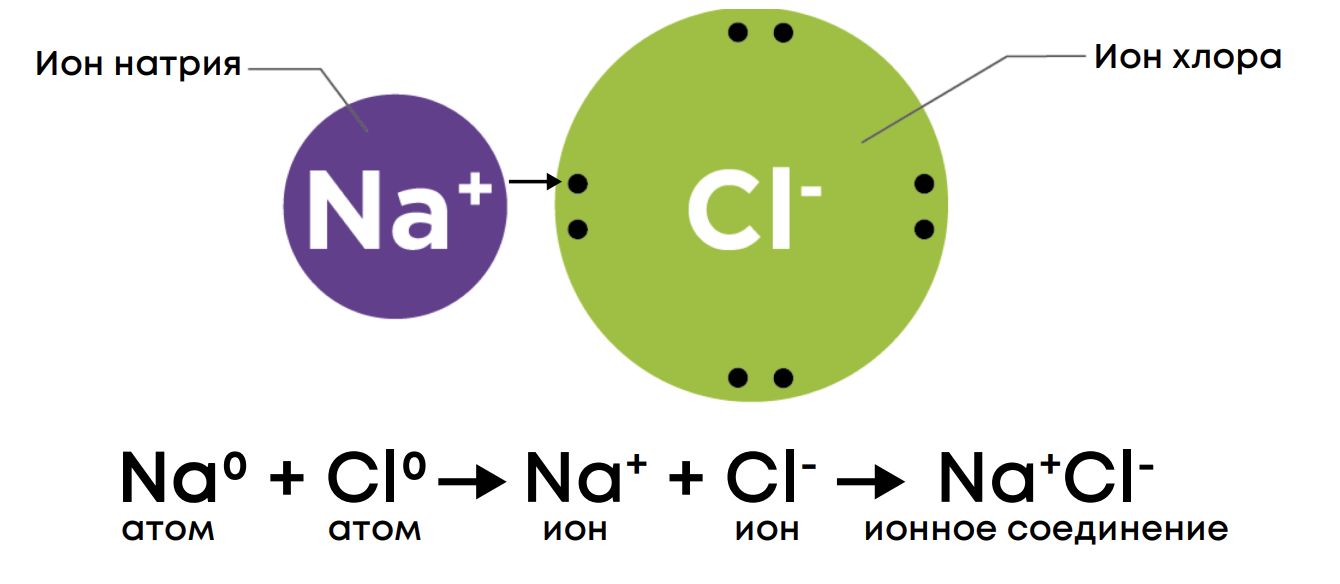
Условный пример, чтобы вы поняли: атом натрия менее электроотрицательный (менее «жадный» до электронов), атом хлора – наоборот. При образовании химической связи натрий отдаёт хлору валентный электрон и превращается в катион (протонов на 1 больше электронов), а хлор – в анион (протонов на 1 меньше электронов). Теперь разноимённые заряды притягиваются и мы получили ионный кристалл NaCl. Заряды частиц – и + и являются степенями окисления.
P.S. В случае ионной связи реальный заряд иона и есть его условный заряд – степень окисления. Но что в случае ковалентной полярной связи? Там нет реальных ионов, только слабые частичные заряды которые обозначаются греческой буквой «сигма», образующиеся из-за неравномерного распределения электронной плотности. Вот в этом случае заряд и является лишь условностью и мы представляем, будто полярная связь – ионная (хотя никаких ионов и реальных зарядов там нет).
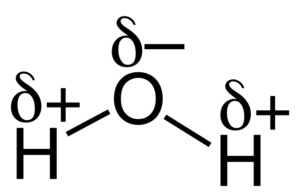
Например, в молекуле воды более «жадный» кислород имеет частично отрицательный заряд, а более «щедрый» водород – частично положительный. Но мы обозначаем их степени окисления как -2 и +1.
Правила степеней окисления:
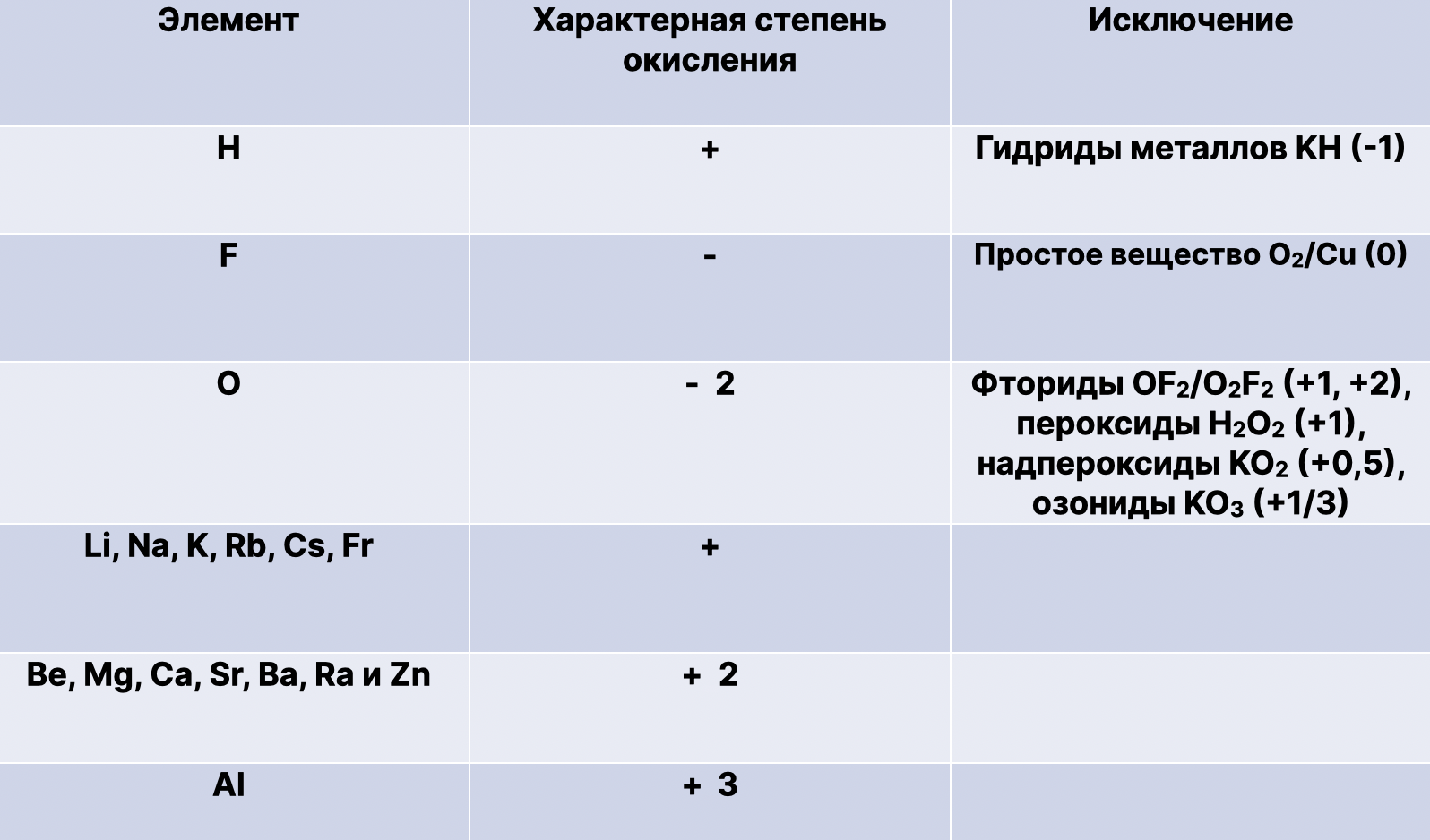
1) С.о. атомов в простых веществах равна 0: Cl2, Cu
2) Сумма с.о. в молекуле равна 0: в H2O 2x(+1)+(-2)=0
3) Кислород чаще всего проявляет с.о. -2
Исключения:
фториды O2F2/OF2 (+1, +2), пероксиды H2O2 (-1), надпероксиды KO2 (-1/2), озониды KO3 (-1/3)
4) Водород чаще всего проявляет с.о. +1
Исключения:
гидриды активных металлов CaH2 (-1)
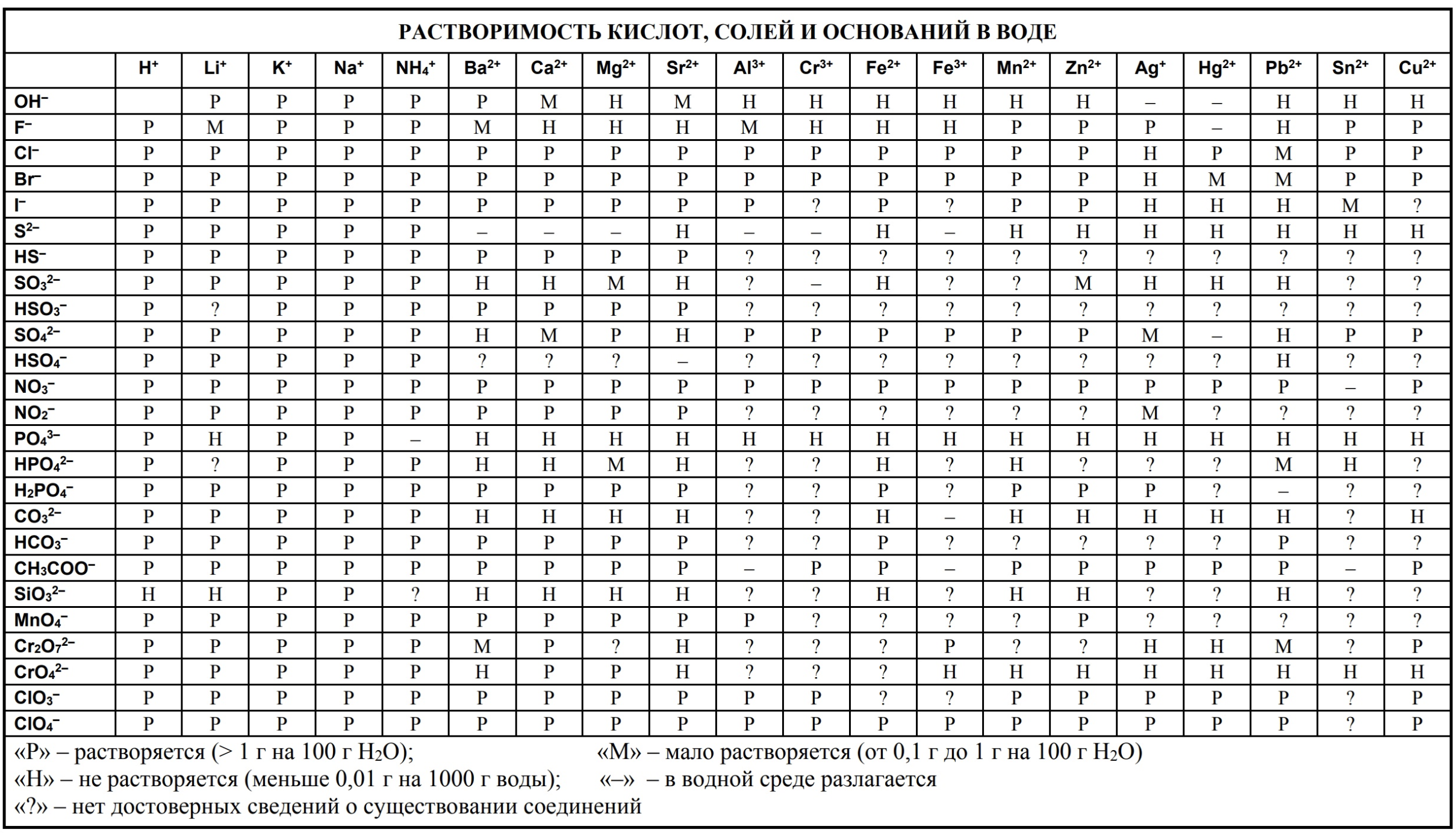
5) У простых ионов с.о. равна заряду иона, смотрим в таблицу растворимости: у Al в таблице растворимости 3+, т.е. степень +3
6) Сумма с.о. атомов в сложном ионе равна заряду иона, смотрим в таблицу растворимости: в SO4 заряд иона 2-, т.е. +6 + (-2)х4 = -2
7) Высшая с.о. равна номеру группы +N
Исключения:
О (+2), F (0), Cu (+2), Fe (+3 и редко +6)
8) Низшая с.о. неметаллов равна номеру группы – 8 (N – 8)
9) Низшая с.о. металлов равна 0 (не может быть отрицательной)
10) В ионной и полярной связи отрицательную степень окисления проявляет более электроотрицательный элемент (в OF2 отрицательный фтор)
Степень окисления чаще всего переменная, но также есть и постоянные степени окисления.
Постоянные степени окисления
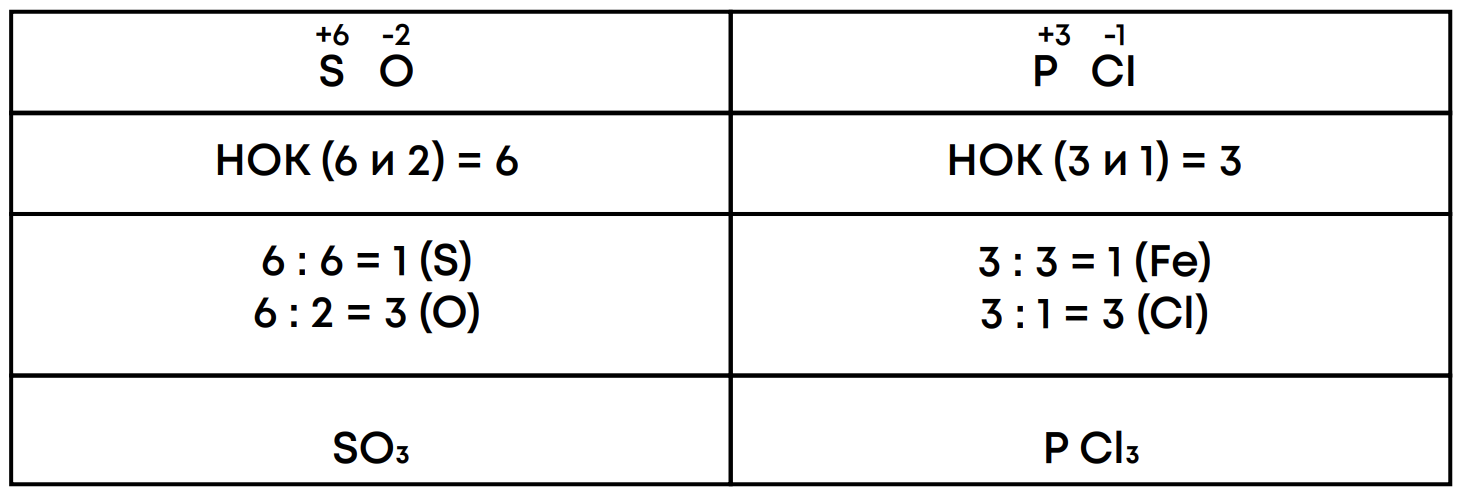
Определяем степень окисления:
1. Записываем формулу вещества
2. Подписываем известные степени окисления, неизвестную обозначаем как x
3. Составляем уравнение для вычисления неизвестного заряда, где приравниваем сумму степеней окисления к нулю (если это формула вещества) или к заряду иона (если это формула иона)
4. Решаем составленное уравнение
5. Подписываем полученную степень окисления
Составляем формулы по степени окисления (для бинарных соединений):
Также не забываем про свою главную помощницу на экзамене – таблицу растворимости. По ней можно быстро ориентироваться и составлять формулы веществ, используя заряды ионов.
К примеру нужно составить формулу гидроксида алюминия. Мы находим заряд иона ОН – и заряд иона Al +3 и быстро понимаем, что нужно 3 гидроксид-аниона, чтобы «погасить» заряд катиона алюминия. Выводим формулу: Al(OH)3 и радуемся жизни!
Кстати, если нам дано название вещества с римской цифрой в скобках, то это значит степень окисления элемента с переменной степенью: хлорид железа (III) = FeCl3
Важно: степень окисления обозначается -2 или +2, а заряд иона – 2- или 2+!