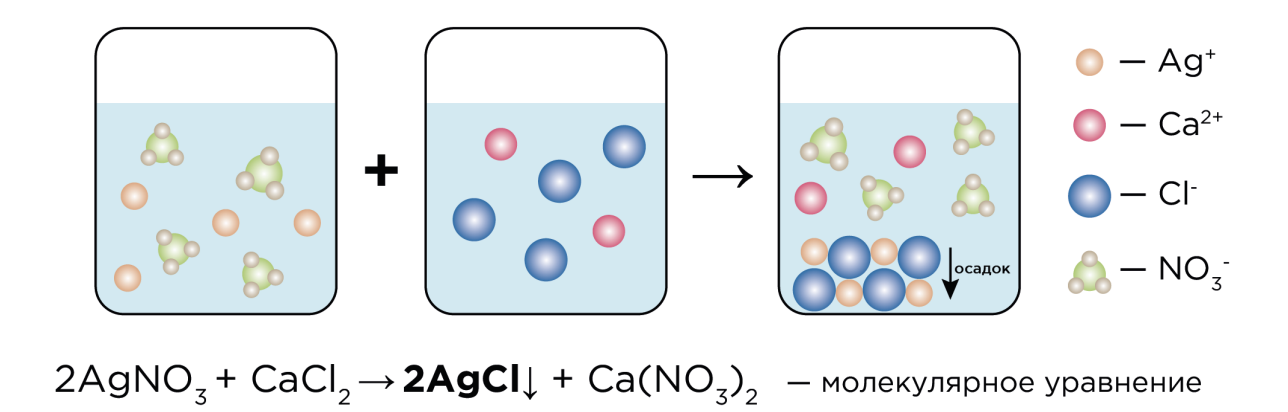
Важнейшими реакциями в программе 8-9 классов являются реакции ионного обмена, протекающие между электролитами в растворах.
Вещества-электролиты (соли, кислоты, основания) находятся в форме ионов в растворе, ионы взаимодействуют между собой с образованием слабого электролита, который плохо диссоциирует и реакция становится необратимой.
Реакции ионного обмена – это реакции, протекающие между электролитами (солями, кислотами, основаниями и амфотерными гидроксидами) в водных растворах
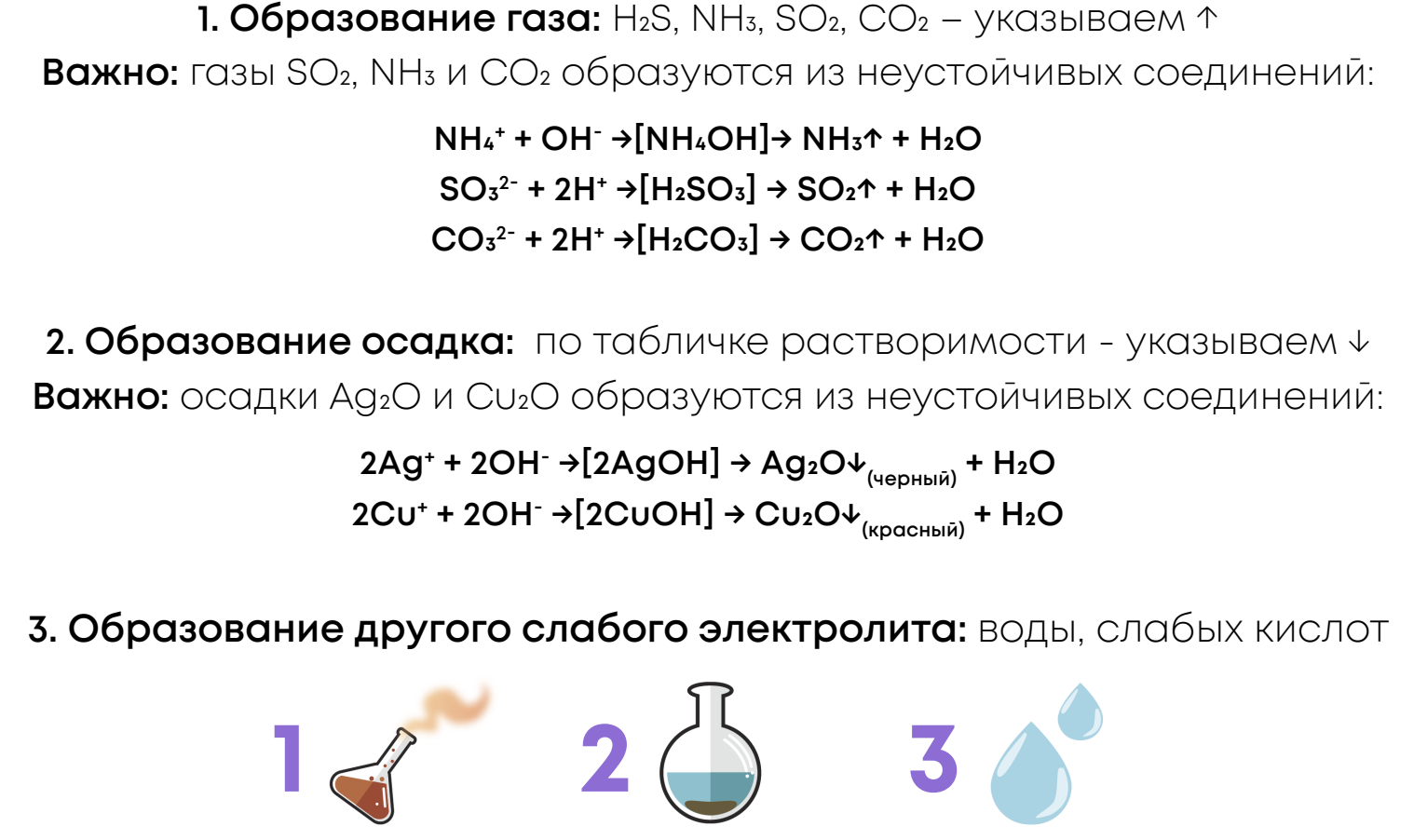
Для протекания реакций ионного обмена необходимы признаки необратимости – образование каких-либо слабых электролитов в продуктах реакции, что не даёт реакциям протекать в обратном направлении (из продуктов в реагенты). Если ни одного признака необратимости нет, то реакцию считаем обратимой (т.е. не протекает).
Реакция соли и основания
Условия: оба реагента растворимы и есть признак необратимости в продуктах
CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl (все условия соблюдены)
FeS + NaOH → нет реакции (реагент нерастворим)
NaCl + KOH → нет реакции (нет признака необратимости)
Реакция соли и кислоты
Условия: есть признак необратимости в продуктах
K2SiO3 + 2HCl → H2SiO3↓ + 2KCl
NaHS + HCl → H2S↑ + NaCl
Na2SO3 + H2SO4 → Na2SO4 + SO2↑ + H2O
MgСO3 + H2SO4 → MgSO4 + СO2↑ + H2O
KNO2 + HCl → HNO2 + KCl (признак – слабая азотистая кислота)
HCl + KI → не протекает (нет признака необратимости)
Реакция основания/амфотерного гидроксида и кислоты (нейтрализация)
Условия: хотя бы один реагент – сильный электролит
NaOH + HCl → NaCl + H2O
2NaOH + H2S → Na2S + 2H2O (щёлочь в избытке, образуется средняя соль)
NaOH + H2S → NaHS + H2O (кислота в избытке, образуется кислая соль)
Al(OH)3 + H2S → не протекает (оба реагента – слабые электролиты)
Реакция соли и соли
Условия: оба реагента растворимы и есть признак необратимости в продуктах
CuCl2 + 2AgNO3 → 2AgCl↓ + Cu(NO3)2
ZnS + CuCl2 → не протекает (реагент нерастворим)
KCl + Na2SO4 → не протекает (нет признака необратимости)
Уравнение реакции ионного обмена можно записать в трёх формах:
Молекулярное уравнение: показывает реакцию, будто бы у нас реагируют молекулы (но это не так!)
Полное ионное уравнение: показывает реакцию в ионной форме, с указанием всех ионов веществ-участников реакции
Сокращённое ионное уравнение: показывает реакцию в ионной форме с указанием только признака реакции
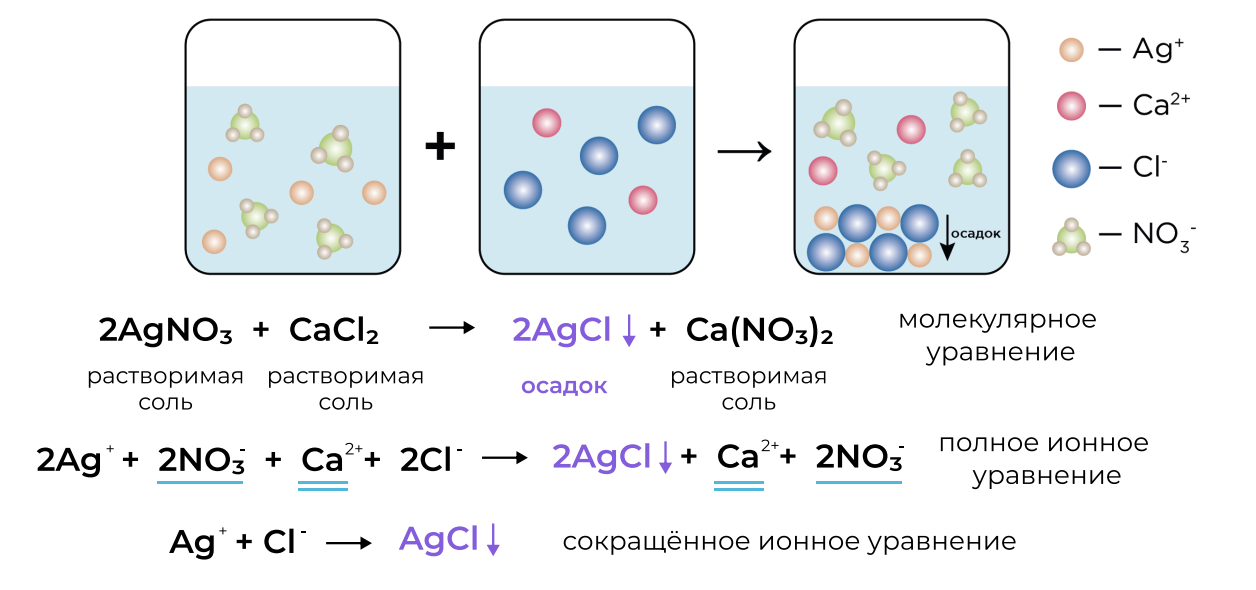
Алгоритм составления ионных уравнений:

В ионных уравнениях расписываем на ионы: растворимые соли, сильные кислоты, сильные основания (щёлочи). Всё остальное оставляем в молекулярной форме!