Окислительно-восстановительные реакции (ОВР) также занимают важное место в химии и школьной программе. Можно сказать, что большинство реакций является ОВРками, то есть протекают с изменением степеней окисления атомов.
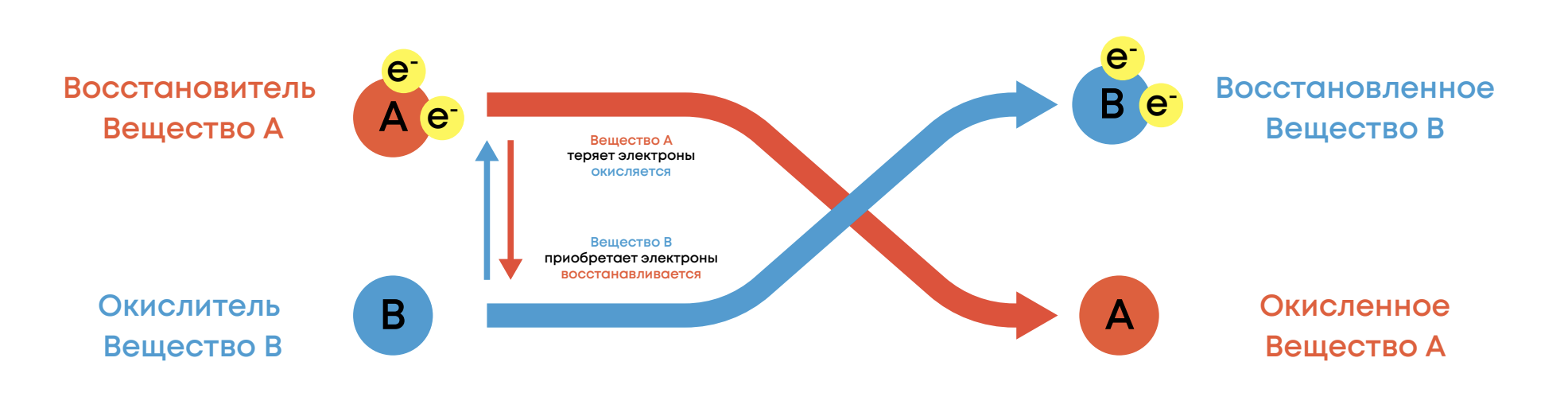
Окислительно-восстановительные реакции (ОВР) – это реакции протекающие с изменением степени окисления атомов элементов из-за процесса перехода электронов
Важные понятия:
Окислитель – вещество или атом в составе вещества, которое принимает
электроны и понижает с.о. (восстанавливается)
Восстановитель – вещество или атом в составе вещества, которое отдаёт
электроны и повышает с.о. (окисляется)
Окисление – процесс отдачи электронов восстановителем
Восстановление – процесс принятия электронов окислителем
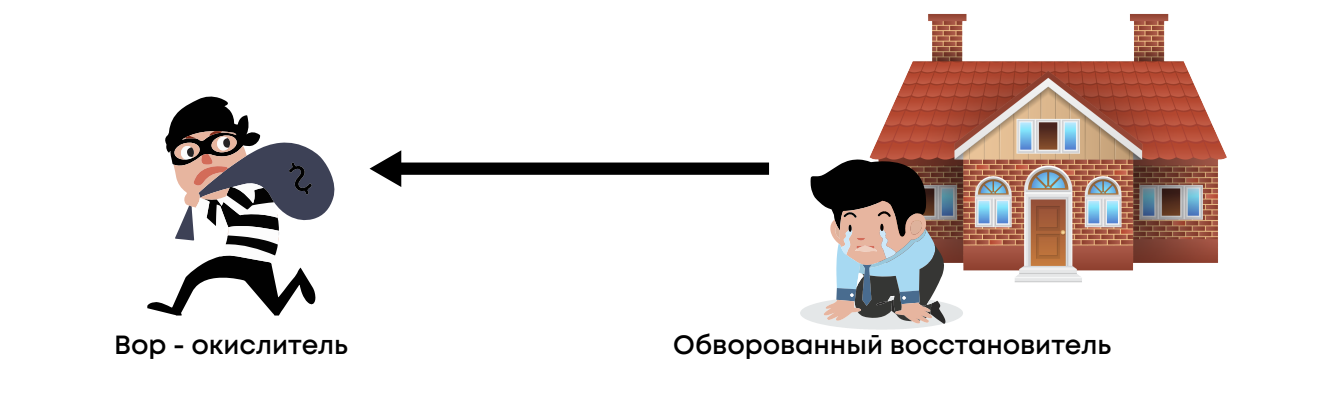
Запоминалка: восстановитель – это тот, кто электроны отдаёт; а отдаёт грабителю, злодею-окислителю
Окислительно-восстановительные реакции разделяются на 4 типа:
1. Межмолекулярные окислительно-восстановительные реакции: окислитель и восстановитель – разные элементы в разных веществах

2. Внутримолекулярные окислительно-восстановительные реакции: окислитель и восстановитель – разные элементы в одном веществе
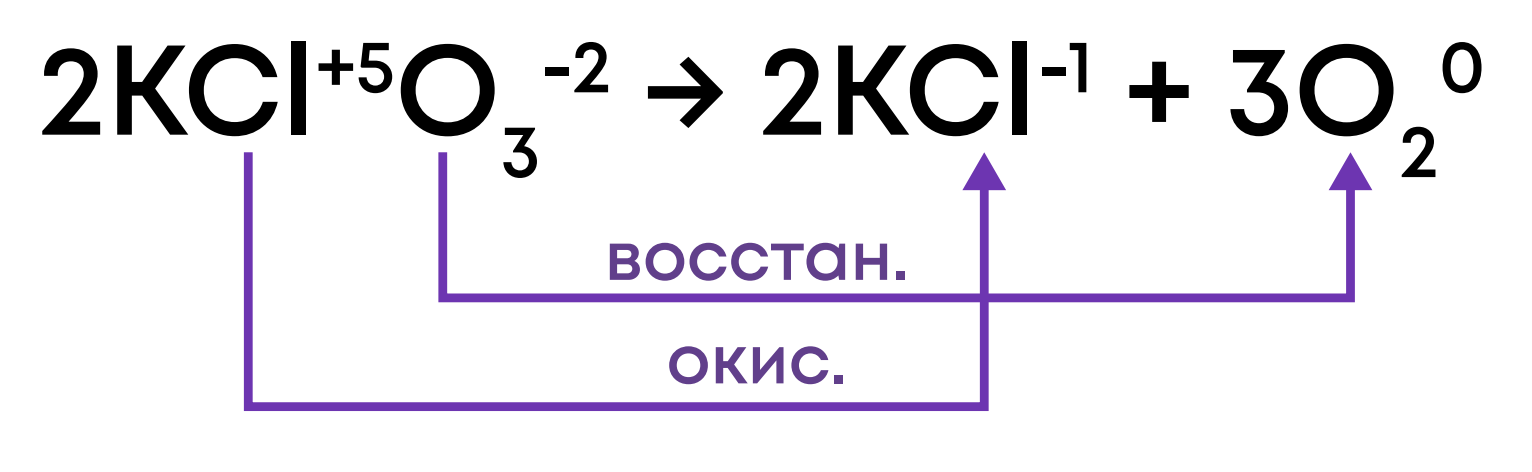
3. Диспропорционирование (самоокисление-самовосстановление): окислитель и восстановитель – один элемент в одном веществе
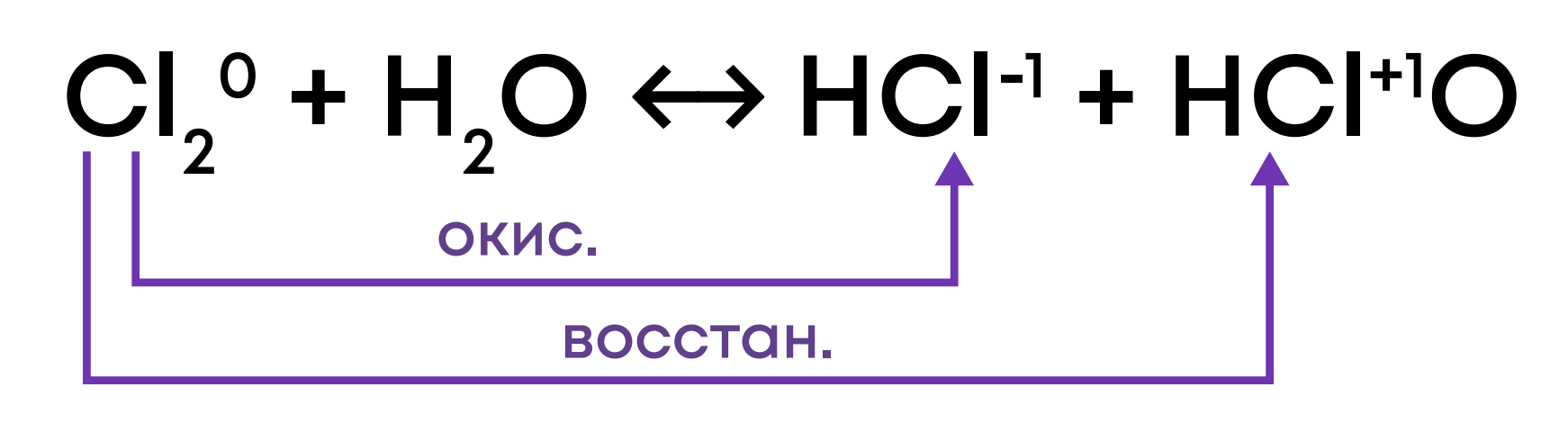
4. Конпропорционирование (сопропорционирование): окислитель и восстановитель – один элемент в разных веществах

Типичными окислителями являются вещества, которые содержат элемент в высокой степени окисления или же электроотрицательные простые вещества:

Типичными восстановителями являются вещества, которые содержат элемент в низкой степени окисления или простые вещества с низкой электроотрицательностью:

Типичными окислителями-восстановителями можем считать соединения с элементом в промежуточной степени окисления:

Для уравнивания ОВРок, уравнять которые стандартным методом подбора коэффициентов трудно, пользуются методом электронного баланса. Он основывается на равенстве отданных и принятых электронов в реакции, ведь электроны не могут появляться из ниоткуда и исчезать в никуда.
Рассмотрим метод электронного баланса на примере:
Дана схема химической реакции и уравнять её подбором трудно:
Cu + HNO3 → Cu(NO3)2 + NO + H2O
1. Укажем степени окисления химических элементов в реакции:
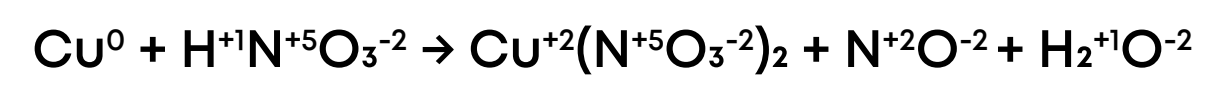
2. Выпишем элементы, поменявшие степени окисления, укажем количество принятых-отданных электронов (отрицательно заряжены) и подпишем процессы окисления-восстановления и окислитель-восстановитель:  3. Определим наименьшее общее кратное у изменения количества электронов, у 2 и 3 это 6. Далее разделим НОК на 2 получаем коэффициент 3 для меди, делим НОК на 3 получаем коэффициент 2 для азота:
3. Определим наименьшее общее кратное у изменения количества электронов, у 2 и 3 это 6. Далее разделим НОК на 2 получаем коэффициент 3 для меди, делим НОК на 3 получаем коэффициент 2 для азота:
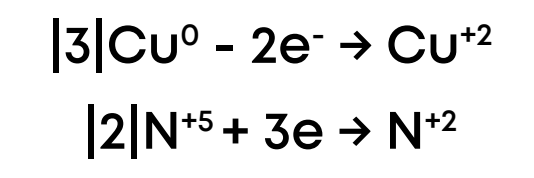
4. Поставим коэффициент 3 на медь и нитрат меди, а коэффициент 2 только на оксид азота, т.к. не все атомы азота меняют с.о. и коэффициент для азотной кислоты должен учитывать и азоты в нитрате меди:

5. Доуравниваем реакцию стандартным методом: суммируем атомы азота справа и выводим коэффициент для азотной кислоты, далее доуравниваем водород и ставим коэффициент на воду:
![]()
6. Производим проверку по единственному элементу, который не считали – по кислороду. Считаем кислород слева и справа, получаем по 24 атома с каждой стороны. Реакция уравнена!
P.S. При уравнивании лучше соблюдать следующий порядок: сначала уравниваем все элементы кроме кислорода-водорода, затем водород и производим проверку по кислороду