Водород – элемент IA группы 1 периода ПСХЭ (также его традиционно располагают в VIIA группе из двойственных свойств). Обычно проявляет в соединениях степень окисления +1, но также в гидридах металлов может быть -1. На внешнем электронном слое атома находится 1 электрон, поэтому атом водорода может его отдать более электроотрицательному атому или принять 1 электрон и перейти в стабильную электронную конфигурацию гелия.
По физическим свойствам простое вещество водород Н2: бесцветный горючий газ без вкуса и запаха, нерастворим в воде, очень лёгкий. В простом веществе водород представлен двухатомными молекулами.

В природе водород чрезвычайно распространён, но из-за химической активности встречается в основном в виде соединений: органических веществ, воды, сероводорода и т.д.
Получение
1. В лаборатории обычно используют реакцию кислот-неокислителей с металлами активнее водорода в специальных аппаратах для получения газов и используют специфические методы сбора:
Zn + 2HCl → ZnCl2 + Н2↑
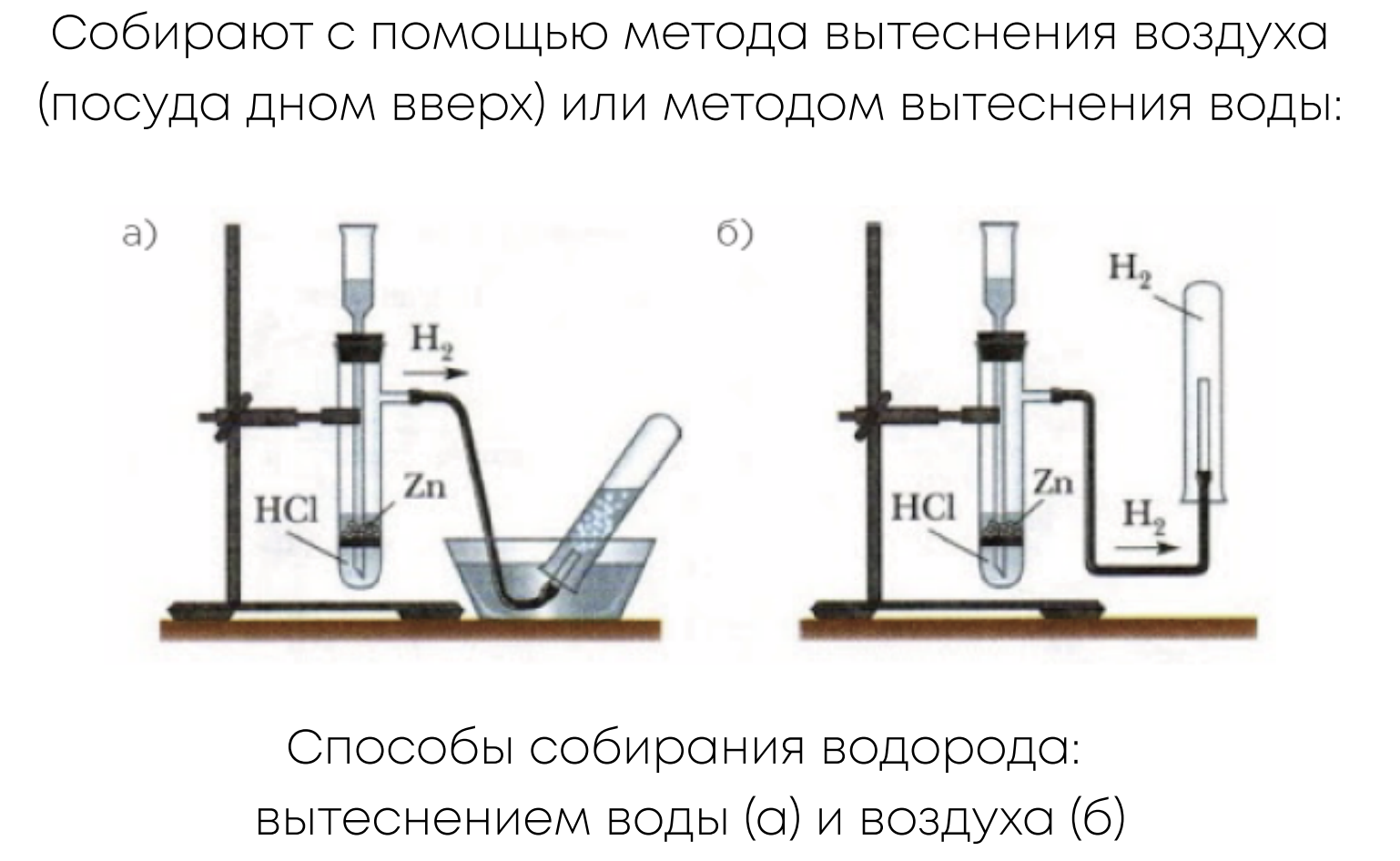

Также могут использоваться реакции:
Взаимодействие активных металлов с водой:
2K + 2H2O → 2KOH + Н2↑
Взаимодействие алюминия/цинка/бериллия с раствором щёлочи:
2Al + 2KOH + 6H2O → 2K[Al(OH)4] + 3Н2↑
Гидролиз гидридов металлов:
NaH + H2O → NaOH + H2↑
NaH + HCl → NaCl + H2↑
Электролиз воды:
2H2O → 2H2↑ + O2↑
2. В промышленности используют реакции:
1. Пиролиз углеводородов (разложение при нагревании):
СН4 → С + 2Н2
2. Конверсия метана на катализаторе (при нагревании):
СН4 + H2O ↔ CO + 3H2
3. Газификация угля (при нагревании):
С + H2O ↔ CO + H2
4. Электролиз воды (электрический ток):
2H2O → 2H2↑ + O2↑
Химические свойства
1. Взаимодействие с активными металлами при нагревании:
Образует гидриды при нагревании (с.о. -1):
2Na + H2 → 2NaH
Ca + H2 → CaH2
Гидриды реагируют с водой и кислотами:
NaH + H2O → NaOH + H2↑
NaH + HCl → NaCl + H2↑
2. Реакции с оксидами:
Реагирует с оксидами металлов после Al в ряду активности при нагревании:
CuO + H2 → Cu + H2O
Смесь оксида углерода (II) и водорода – синтез-газ, используется при получении метанола, формальдегида и синтетического бензина
на катализаторах при нагревании и давлении:
CO + 2H2 ↔ CH3OH
Восстанавливает оксиды азота до азота:
N2O + H2 → N2 + H2O
3. При нагревании взаимодействует с серой до сероводорода:
H2 + S → H2S
4. С кислородом горение со взрывом (смесь кислорода/воздуха и водорода называется “гремучий газ”):
2Н2 + О2 → 2Н2О
5. С азотом (реакция Габера-Боша) на катализаторе (пористое железо), при
нагревании и давлении получают аммиак:
3H2 + N2 ↔ 2NH3
Не реагирует с фосфором!
6. С углеродом при повышенном давлении и температуре, на катализаторах образует углеводороды (запомнить реакцию до образования метана):
C + 2H2 → CH4
Не реагирует с кремнием!
7. С галогенами:
С фтором – со взрывом, с хлором/бромом – только при нагревании или облучении светом, с иодом – обратимая реакция при сильном нагревании:
H2 + Hal2 → 2HHal
Применение

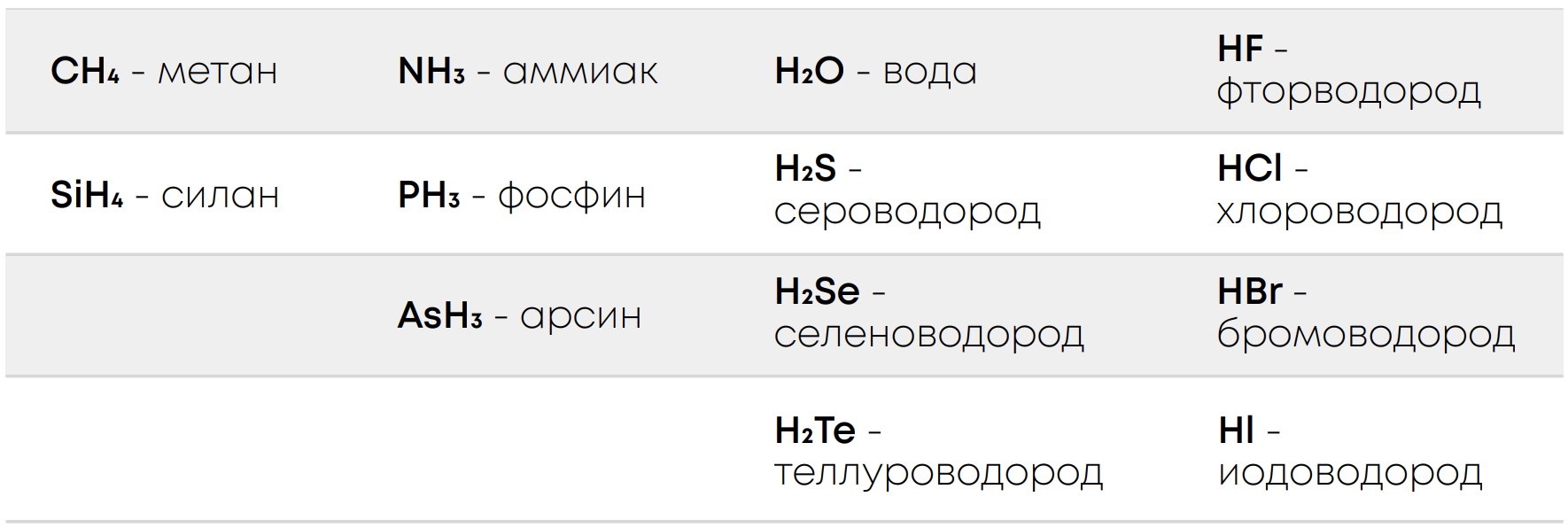
Летучие водородные соединения
Галогены (“рождающие соли”) – элементы VIIA группы ПСХЭ: F, Cl, Br, I, At (астат рассматривать не будем из-за его редкости и радиоактивности). Фтор проявляет в соединениях степень окисления -1 и не может проявлять положительные степени из-за самой высокой электроотрицательности. Для остальных галогенов характерны степени окисления в соединениях: -1, +1, +3, +5, +7.
Физические свойства
Все галогены – токсичные вещества с двухатомными молекулами. Фтор F2 – жёлтый газ, хлор Cl2 – зелёный газ, бром Br2 – бурая жидкость, иод I2 – серо-фиолетовые кристаллы (способен к возгонке в фиолетовые пары) при н.у.

Активность галогенов и их окислительная способность:
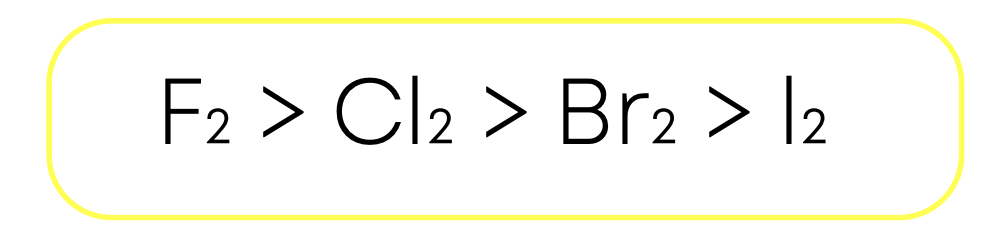
Получение:
1. В лаборатории:
Хлор получают действием соляной кислоты на окислители: MnO2, KMnO4, PbO2, K2Cr2O7 и др.:

Бром и иод получают действием окислителя на бромиды или иодиды в кислой среде:
MnO2 + 2KBr + 2H2SO4 → Br2 + MnSO4 + K2SO4 + 2H2O
2NaNO2 + 2NaI + 2H2SO4 → I2↓ + 2NO↑ + 2NaHSO4 + 2H2O
Фтор в лаборатории не получают из-за сложности и опасности процесса.
2. В промышленности:
Важнейший способ получения фтора – электролиз расплавов фторидов. В качестве основного источника используется гидрофторид калия KHF2, фтор выделяется на аноде.
Хлор в промышленности получают электролизом раствора хлорида натрия. Газообразный хлор выделяется на аноде:
2NaCl + 2H2O → 2NaOH + H2↑ + Cl2↑

Для получения брома используют реакцию его замещения в бромидах:
2KBr + Cl2 → 2KCl + Br2
Основные источники получения иода – морские водоросли и нефтяные буровые воды:
2NaI + MnO2 + 3H2SO4 → I2↓ + 2NaHSO4 + MnSO4 + 2H2O
Химические свойства:
1. Реакции с металлами металлами: фтор со всеми, остальные не реагируют с благородными:
Образуются галогениды (фториды, хлориды, бромиды, иодиды):
Cu + Cl2 → CuCl2
2Na + Br2 → 2NaBr
Fe + I2 → FeI2
2Au + 3F2 → 2AuF3
2. Взаимодействие с водородом:
С фтором – со взрывом, с хлором/бромом – только при нагревании или облучении светом, с иодом – сильнообратимая реакция при сильном нагревании:
H2 + F2 → 2HF
H2 + Cl2 → 2HCl
H2 + Br2 → 2HBr
H2 + I2 → 2HI
3. Взаимодействие с фосфором:
В избытке и недостатке получаются разные продукты:
2P + 5F2 → 2PF5
2P + 3Cl2 → 2PCl3 – недостаток хлора
2P + 5Cl2 → 2PCl5 – избыток хлора
2P + 3Br2 → 2PBr3 – недостаток брома
2P + 5Br2 → 2PBr5 – избыток брома
2P + 3I2 → 2PI3
4. С серой реагируют все галогены, кроме иода:
3F2 + S → SF6
S + Cl2 → SCl2
2S + Cl2 → S2Cl2
2S + Br2 → S2Br2
5. С кислородом взаимодействует только фтор в электрическом разряде до фторида:
O2 + 2F2 → 2OF2
6. С азотом реагирует только фтор в электрическом разряде:
N2 + 3F2 → 2NF3
7. С углеродом взаимодействует только фтор:
При высокой температуре образует фторид:
С + 2F2 → CF4
8. С водой взаимодействуют галогены за исключением иода:
H2O + 2F2 → 2HF + OF2
H2O + Cl2 ↔ HClO + HCl – хлорная вода
H2O + Br2 ↔ HBrO + HBr – бромная вода
9. Реакции с щелочами в растворе:
2NaOH + 2F2 → OF2 + 2NaF + H2O – не встречается
2NaOH + Cl2/Br2 → NaCl/NaBr + NaClO/NaBrO + H2O (на холоду)
6NaOH + 3Cl2/Br2 → 5NaCl/NaBr + NaClO3/NaBrO3 + 3H2O (при нагревании)
6NaOH + 3I2 → 5NaI + NaIO3 + 3H2O – в любом случае
10. Реакции замещения:
Более активные галогены способны замещать менее активные из галогенидов и галогеноводородов:
2NaBr + Cl2 → 2NaCl + Br2
2HI + Br2 → 2HBr + I2↓
Бром вытесняет серу из сульфидов и сероводорода:
H2S + Br2 → 2HBr + S↓
Хлор будет окислять до серной кислоты (хлорная вода – хороший окислитель):
H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl
11. C кислотами-окислителями реагирует только иод:
Иод способен реагировать с концентрированной азотной кислотой при нагревании:
I2 + 10HNO3 (конц.) → 2HIO3 + 10NO2↑ + 5H2O
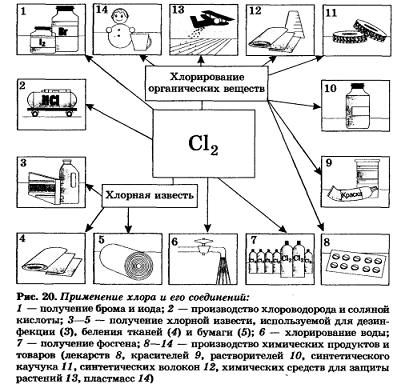
Применение:
Фтор: при синтезе полимерных материалов (фторопласты); как окислитель
ракетного топлива; жидкости (фреоны) для холодильных машин
Хлор: для синтеза соляной кислоты, хлорной извести, винилхлорида,
хлорпренового каучука; для отбеливания тканей и бумажной массы;
для обеззараживания питьевой воды
Бром: для приготовления лекарств; для получения различных органических веществ; в лакокрасочной промышленности
Иод: для приготовления лекарств (“йод” – раствор иода в спирте, антисептик); в анализе веществ
Кислородсодержащие соединения хлора (для брома и иода названия и формулы аналогичны):

