Халькогены (“рождающие руды”) – это элементы VIA группы ПСХЭ: O, S, Se и др. Разберём два первых элемента и их простых вещества, которые являются наиболее важными в химии.
Кислород – элемент VIA группы 2 периода ПСХЭ. Характерные степени окисления в соединениях: -2, -1, -0,5, +1, +2. Последние две встречаются во фторидах.
Кислород проявляет аллотропию (полиморфизм), т.е. химический элемент образует несколько простых веществ или аллотропных модификаций. Кислород образует два простых вещества: молекулярный кислород О2 и озон О3.
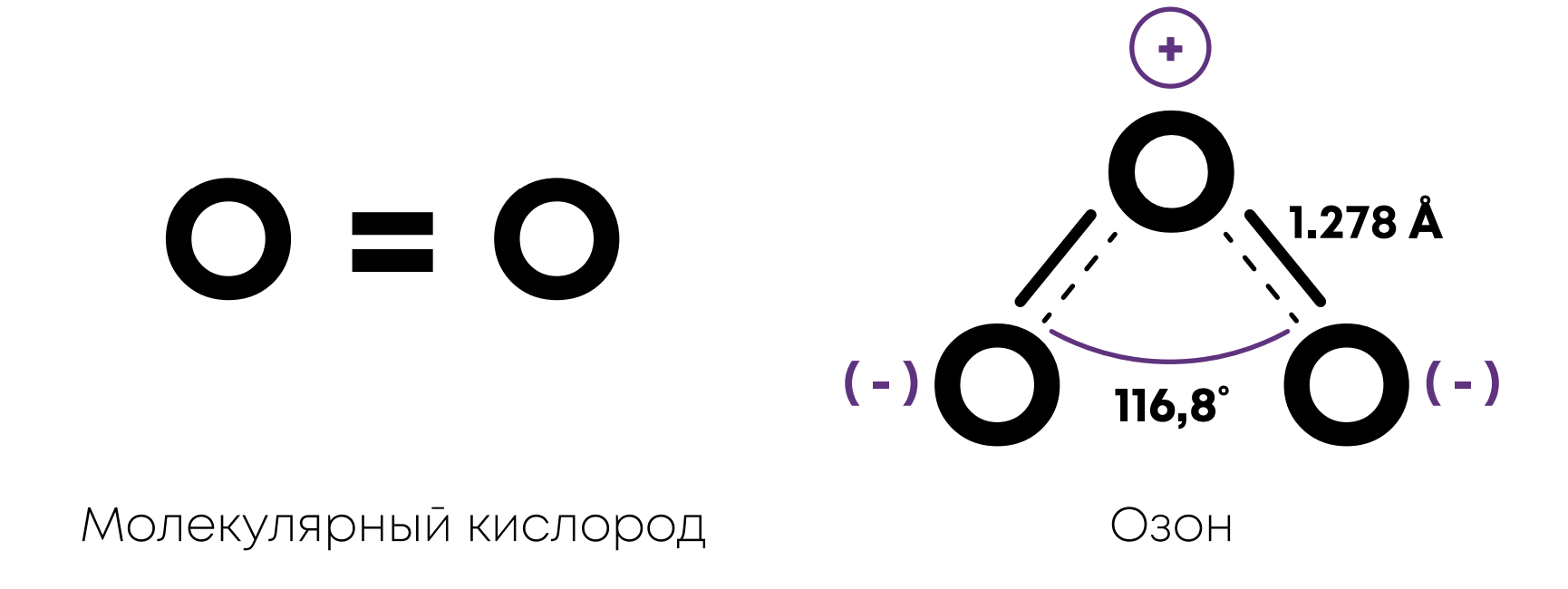
Сравнение кислорода и озона:
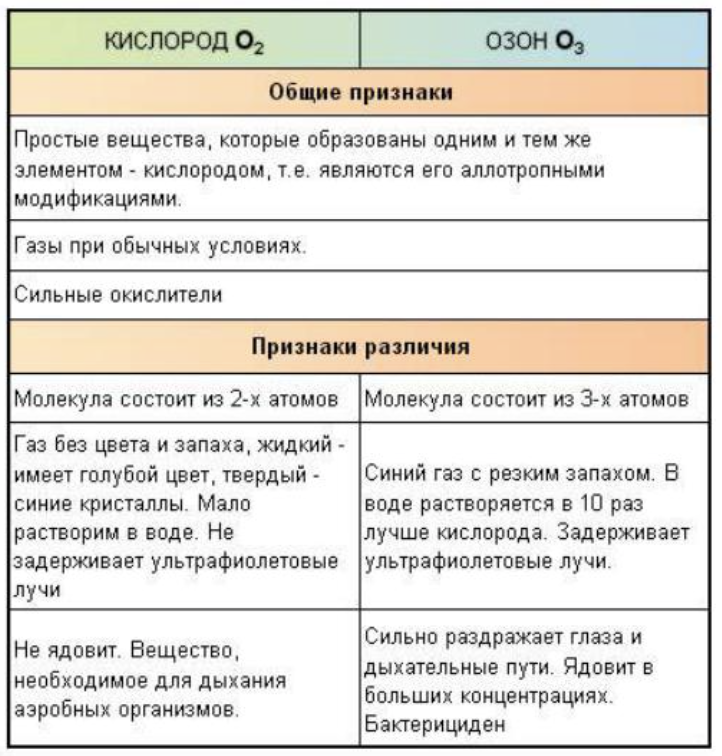
Кислород – самый распространенный в земной коре элемент, он встречается в виде озона и кислорода в атмосфере, образует минералы и входит в состав органических веществ.
Получение:
1. В лаборатории получают разложением кислородсодержащих соединений:
Разложение перманганата калия:
2KMnO4 → K2MnO4 + MnO2 + O2↑
Разложение хлората калия (катализатор MnO2):
2KClO3 → 2KCl + 3O2↑
Разложение пероксида водорода (катализатор MnO2):
2H2O2 → 2H2O + O2↑
Также применяется разложение нитратов и электролиз воды

2. В промышленности кислород получают перегонкой воздуха (разделение смеси веществ с различной температурой кипения) и электролизом воды

3. В природе кислород получается при фотосинтезе растений:
6Н2О + 6СО2 → 6О2↑ + С6Н12О6

Химические свойства
Кислород из-за высокой электроотрицательности в реакциях чаще выступает в роли окислителя, химически активен. Восстановителем является только в реакциях со фтором. Озон – наиболее химически активная форма кислорода, но менее стабильная. Часто экзотермические реакции окисления веществ кислородом называют горением.
1. Взаимодействует с металлами, кроме благородных (чаще при нагревании):
В большинстве случаев образуются оксиды металлов:
Ca + O2 → 2CaO
3Fe + 2O2 → Fe3O4 – до железной окалины (FeO + Fe2O3)
Щелочные металлы взаимодействуют до образования пероксидов или надпероксидов (кроме лития – до оксида):
4Li + O2 → 2Li2O – до оксида (с.о. О равна -2)
2Na + O2 → Na2O2 – до пероксида (с.о. О равна -1)
K + O2 → KO2 – до надпероксида (с.о. О равна -1/2)
Rb + O2 → RbO2 – до надпероксида (с.о. О равна -1/2)
Cs + O2 → CsO2 – до надпероксида (с.о. О равна -1/2)
2. Взаимодействует с серой (нагревание):
Горение до сернистого газа:
S + O2 → SO2
Сернистый газ на катализаторе (V2O5) может быть окислен до триоксида:
2SO2 + O2 ↔ 2SO3
3. Взаимодействует с фосфором (при нагревании):
Образуется триоксид или пентаоксид (избыток-недостаток):
P + O2 → P2O3/P2O5
4. Взаимодействие с азотом:
При сильном нагревании или при электрическом разряде (пример эндотермической реакции окисления кислородом):
N2 + O2 ↔ 2NO
5. С углеродом:
До углекислого или угарного газа (избыток-недостаток):
C + O2 → CO2 – избыток кислорода
2C + O2 → 2CO – недостаток кислорода
6. Реакция с кремнием идёт при сильном нагревании:
Si + O2 → SiO2
7. Горение водорода со взрывом (смесь реагентов называется гремучим газом):
2H2 + O2 → 2H2O
8. Взаимодействие со сложными веществами:
Оксиды (если могут быть доокислены):
4FeO + O2 → 2Fe2O3
2NO + O2 → 2NO2
Гидроксиды и кислоты:
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3
2HNO2 + O2 → 2HNO3
2H2S + O2 (недостаток) → 2S + 2H2O
2H2S + 3O2 (избыток) → 2SO2 + 2H2O
Обжиг сульфидов:
BaS + 2O2 → BaSO4 – сульфид активного металла
2ZnS + 3O2 → 2ZnO + 2SO2 – сульфиды остальных металлов
С аммиаком:
3O2 + 4NH3 → 2N2 + 6H2O – просто горение
5O2 + 4NH3 → 4NO + 6H2О – каталитическое окисление
9. Образование озона в электрическом разряде:
3О2 ↔ 2О3
Химические свойства озона
1. Получение:
3O2 ⇆ 2O3
3H2SO4 + 3BaO2 → 3BaSO4↓ + O3↑ + 3H2O
2. Качественная реакция – образование иода при пропускании через раствор иодида:
2Kl + O3 + H2O → I2↓ + 2KOH + O2
3. Окисляет металлы (даже серебро) и неметаллы:
2Ag + O3 → Ag2O + O2
2C + 2O3 → 2CO2 + O2
4. Разлагается:
2O3 ⇆ 3O2
Применение:

Сера – элемент VIA группы 3 периода ПСХЭ. Характерные степени окисления в соединениях -2, +2, +4, +6.
У серы есть три аллотропные модификации: сера ромбическая, сера моноклинная, сера пластическая. Но самой устойчивой при обычных условиях модификацией является ромбическая сфера.
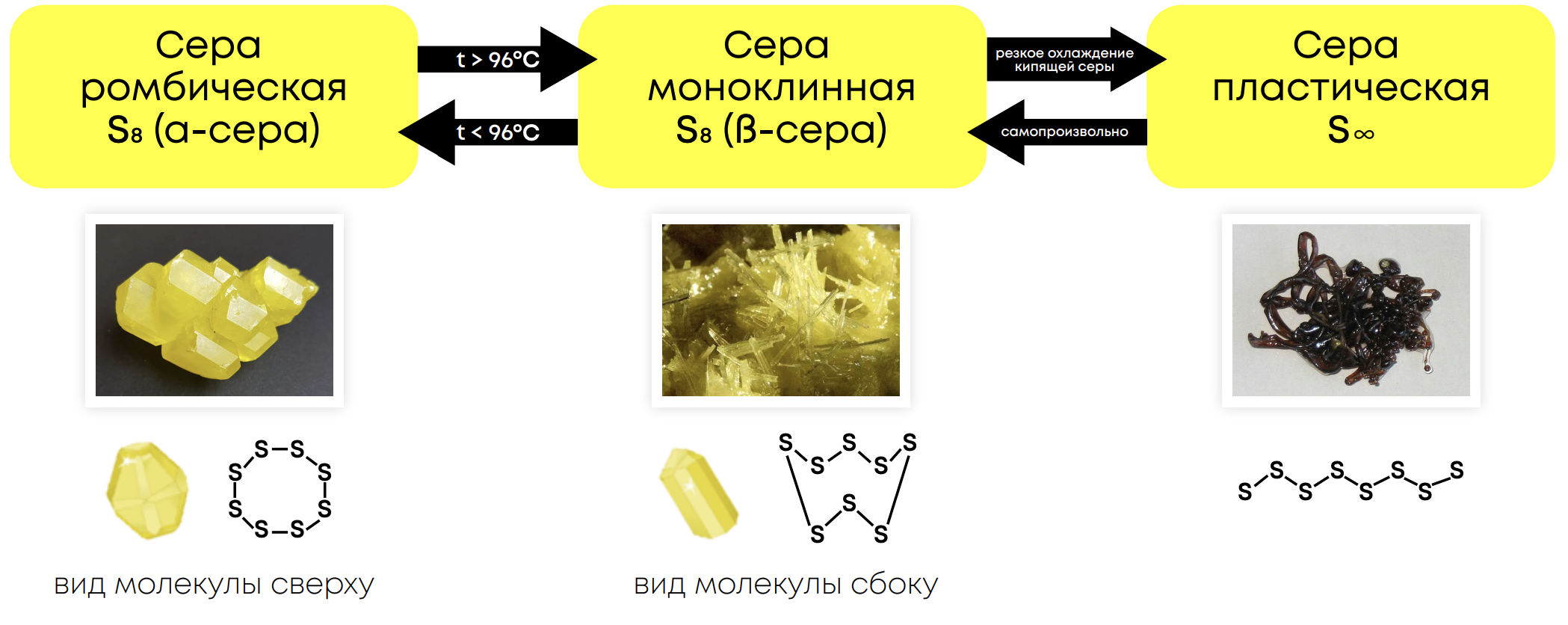
Физические свойства:

В природе сера встречается в самородном состоянии в виде простого вещества, а также образует минералы в форме сульфидов и сульфатов.
Получение серы:
1. В промышленности серу получают на месторождениях самородной серы, либо из вулканов, а также при очистке нефти.
2. Также с помощью химических реакций:
2H2S + O2 → 2S + 2H2O – кислород в недостатке
2H2S + SO2 → 3S + 2H2O
Химические свойства
1. Взаимодействие с металлами :
При нагревании образуются сульфиды (с.о. -2):
2Na + S → Na2S
2. Реакция с кислородом при нагревании:
Горение до сернистого газа:
S + O2 → SO2
Сернистый газ на катализаторе (V2O5) может быть окислен до триоксида:
SO2 + 2O2 ↔ 2SO3
3. Взаимодействие с водородом при нагревании идёт до образования сероводорода – газа с запахом тухлых яиц:
H2 + S → H2S
4. Взаимодействие с фосфором при нагревании:
2P + 3S → P2S3
5. С галогенами (кроме иода):
3F2 + S → SF6
S + Cl2 → SCl2
2S + Cl2 → S2Cl2
2S + Br2 → S2Br2
6. Взаимодействие с углеродом при нагревании идёт с образованием сероуглерода:
2S + C → CS2
7. С щелочами диспропорционирование при нагревании:
3S + 6NaOH → 2Na2S + Na2SO3 + 3H2O
8. С кислотами-окислителями:
S + 2H2SO4 (конц.) → 3SO2↑ + 2H2O
S + 6HNO3 (конц.) → H2SO4 + 6NO2↑ + 2H2O
S + 2HNO3 (разб.) → H2SO4 + 2NO↑
Применение:

