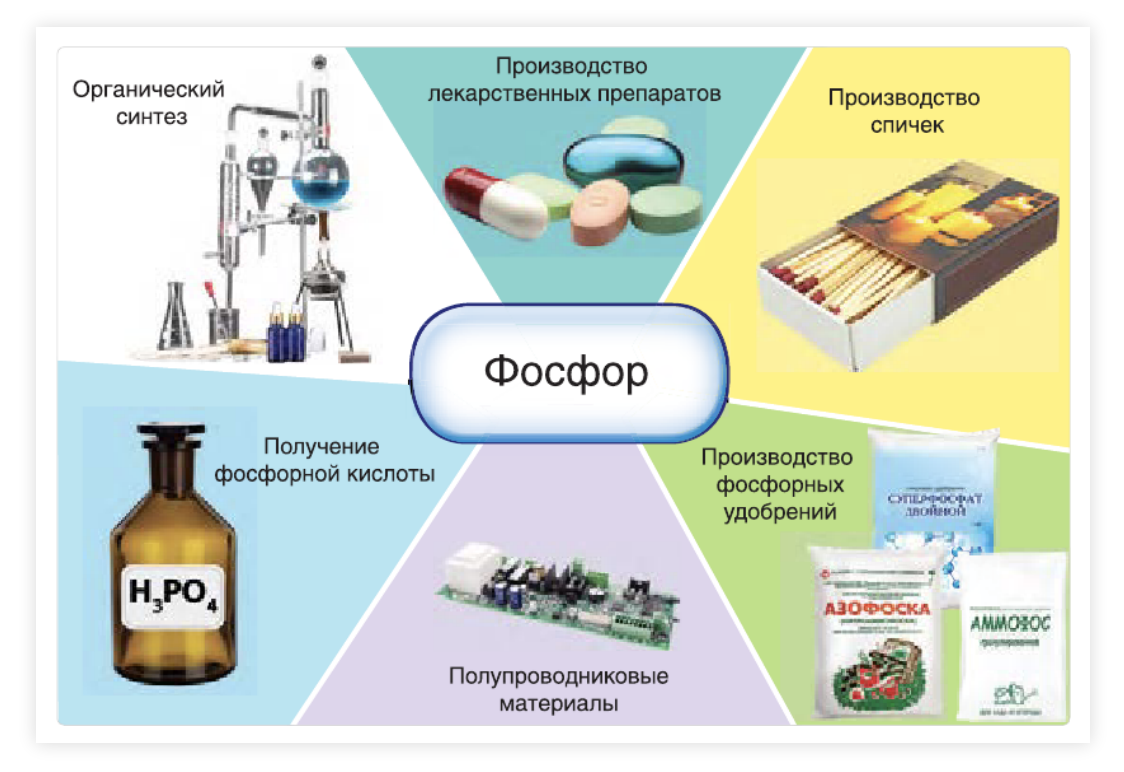
Пниктогены (“удушающие” из-за неспособности азота поддерживать дыхание и горение) – элементы VA группы ПСХЭ: N, P, As и др. Рассмотрим элементы и их соединения на примере азота и фосфора.
Азот – элемент VA группы 2 периода ПСХЭ. Характерны степени окисления в промежутке от -3 до +5.
Азот в природе существует в виде простого вещества газа N2, органических соединений, минералов. Простое вещество – газ, нет цвета, запаха и вкуса. Молекула N2 неполярная, следовательно, в воде азот практически нерастворим. Из-за прочной тройной связи азот инертен и практически не вступает в химические реакции.
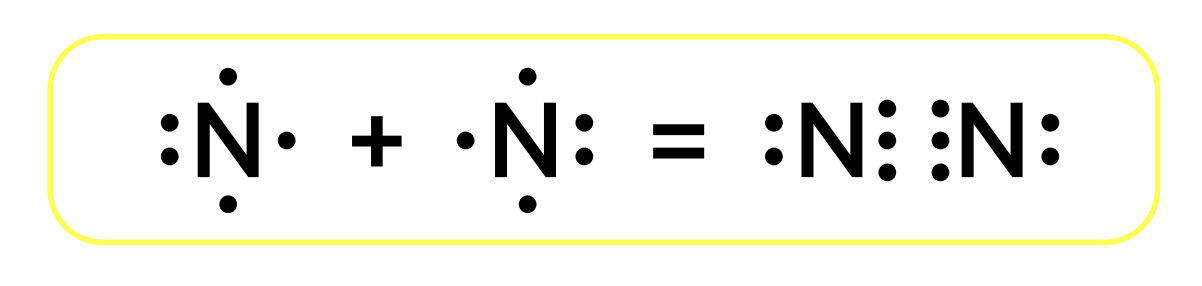
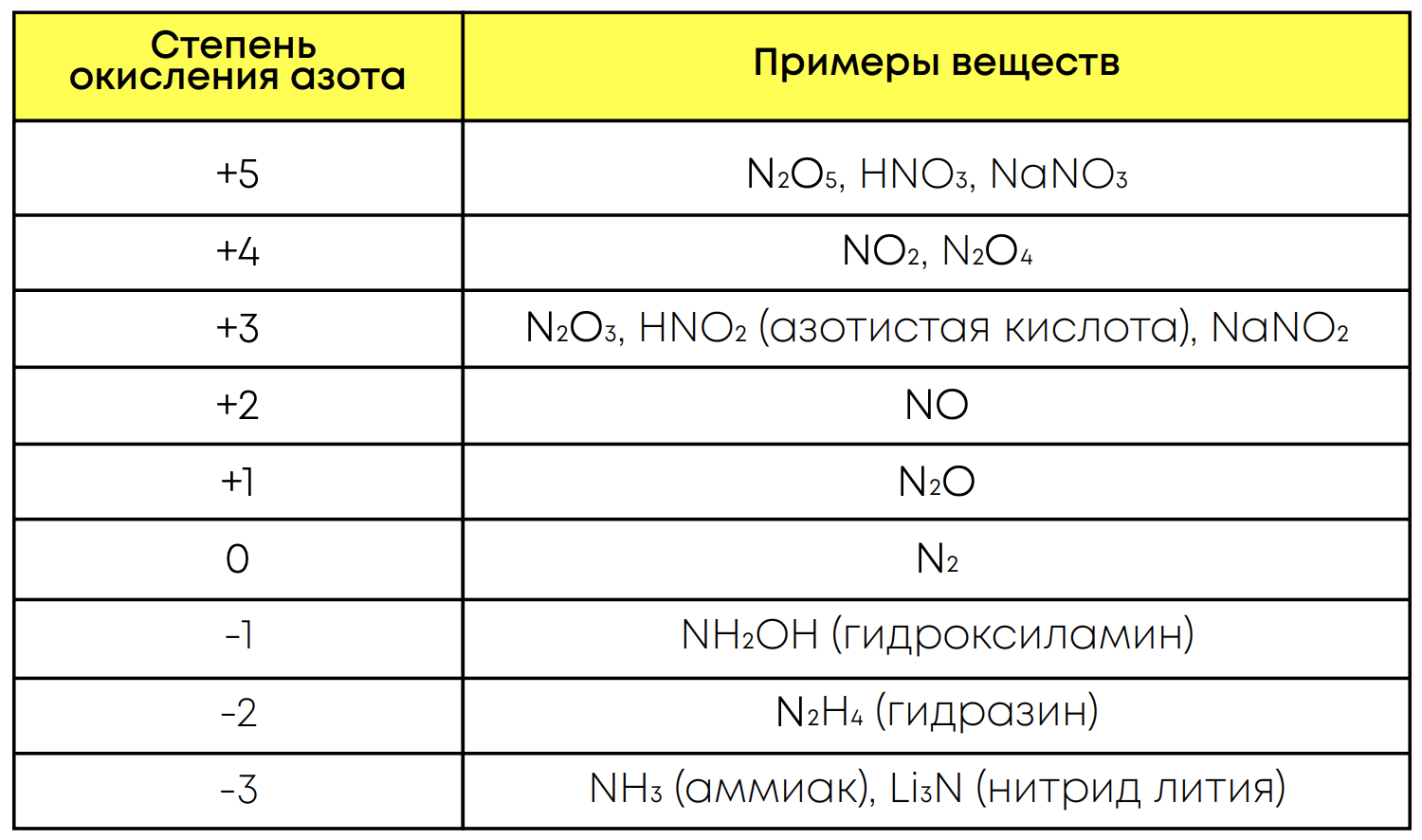
Вещества азота в различных степенях окисления:
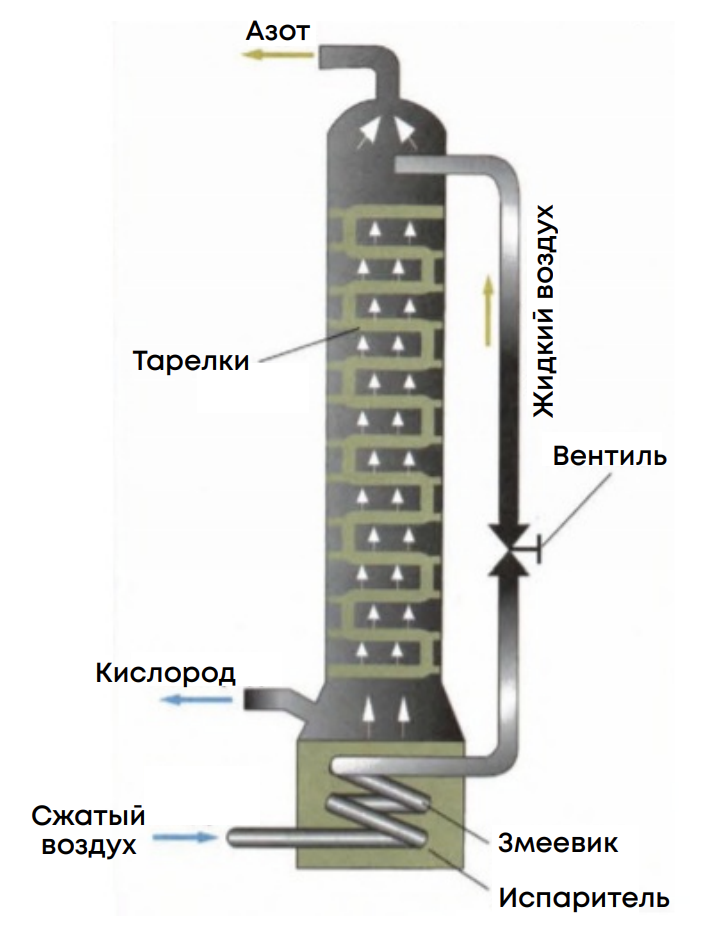
Получение:
1. В промышленности используют фракционную перегонку воздуха:
2. Также можно получить в результате реакций:
NH4NO2 → N2↑ + 2H2O
NaNO2 + NH4Cl → N2↑ + 2H2O + NaCl
2NH3 + 3CuO → N2 + 3Cu + 3H2O
4NH3 + 3O2 → 2N2 + 6H2O
(NH4)2Cr2O7 → N2↑ + Cr2O3 + 4H2O
Химические свойства:
1. Взаимодействие металлами (активными и среднеактивными) – со всеми,
кроме лития с нагревом:
Образует нитриды (с.о. -3):
6Na + N2 → 2Na3N
Нитриды реагируют с водой и кислотами:
Na3N + 3H2O → 3NaOH + NH3↑
Na3N + 4HCl → 3NaCl + NH4Cl
2. Реакция с водородом:
На катализаторе (пористое железо), при нагревании и давлении получают аммиак:
3H2 + N2 ↔ 2NH3
3. С фтором в электрическом разряде образует фторид:
N2 + 3F2 → 2NF3
4. С кислородом при сильном нагревании или при электрическом
разряде (пример эндотермической реакции):
N2 + O2 ↔ 2NO
Применение: жидкий азот – замораживание; инертная атмосфера; синтез аммиака

Аммиак – летучее водородное соединение азота, нитрид водорода; является слабым основанием из-за строения молекулы, в которой присутствует неподелённая пара электронов
Физические свойства: бесцветный газ с резким характерным запахом, ядовит, легче воздуха, хорошо растворим (водный раствор аммиака – нашатырный спирт)
Получение:
1. В лаборатории:

2. В промышленности:

Химические свойства:
1. Горение :
3O2 + 4NH3 → 2N2 + 6H2O – просто горение
5O2 + 4NH3 → 4NO + 6H2О – каталитическое окисление
2. Реакция с оксидами металлов – как восстановитель при нагревании:
2NH3 + 3CuO → N2 + 3Cu + 3H2O
3. Реакция с водой до нашатырного спирта:
NH3 + H2O ↔ NH4OH (NH3 ⋅H2O) – слабое основание, окрашивает индикаторы
4. С кислотами реагирует с образованием солей аммония:
HCl + NH3 → NH4Cl
H2SO4 + NH3 → NH4HSO4
5. Разложение до азота и водорода:
2NH3 ↔ 3H2 + N2
6. С солями может образовывать нерастворимые гидроксиды:
FeSO4 + 2NH3 + 2H2O → Fe(OH)2↓ + (NH4)2SO4
Химические свойства солей аммония:
1. Сильные электролиты, способные диссоциировать на ионы:![]()
2. Реакции ионного обмена обычных солей:
(NH4)2CO3 + 2НCl → 2NH4Cl + Н2O + CO2↑
NH4Cl + KOH → KCl + NH3↑ + H2O
3. Разложение при нагревании:
NH4Cl → NH3↑ + HCl↑
NH4HCO3 → NH3↑ + CO2↑ + H2O↑
(NH4)2SO4 → NH4HSO4 + NH3↑
NH4HS → NH3↑ + H2S↑
NH4NO2 → N2↑ + 2H2O↑
NH4NO3 → N2O↑ + 2H2O↑
(NH4)2Cr2O7 → Cr2O3 + N2↑ + 4H2O↑
Применение
Соли аммония в основном используются в качестве азотных удобрений

Фосфор – элемент VA группы 3 периода ПСХЭ. Характерны степени окисления в соединениях -3, +3, +5.
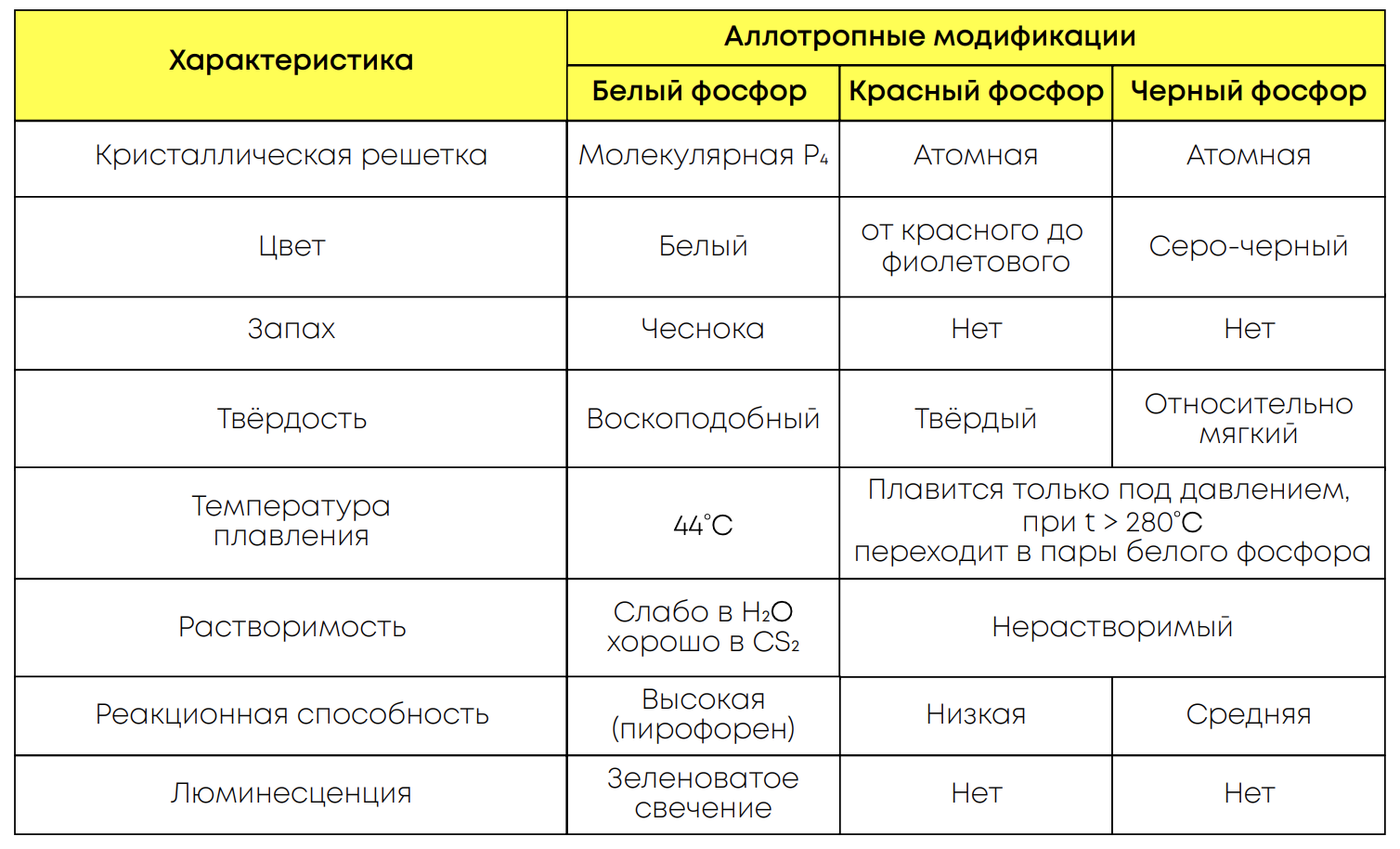
Аллотропия фосфора: фосфор образует три основные аллотропные модификации – белый, красный и черный фосфор
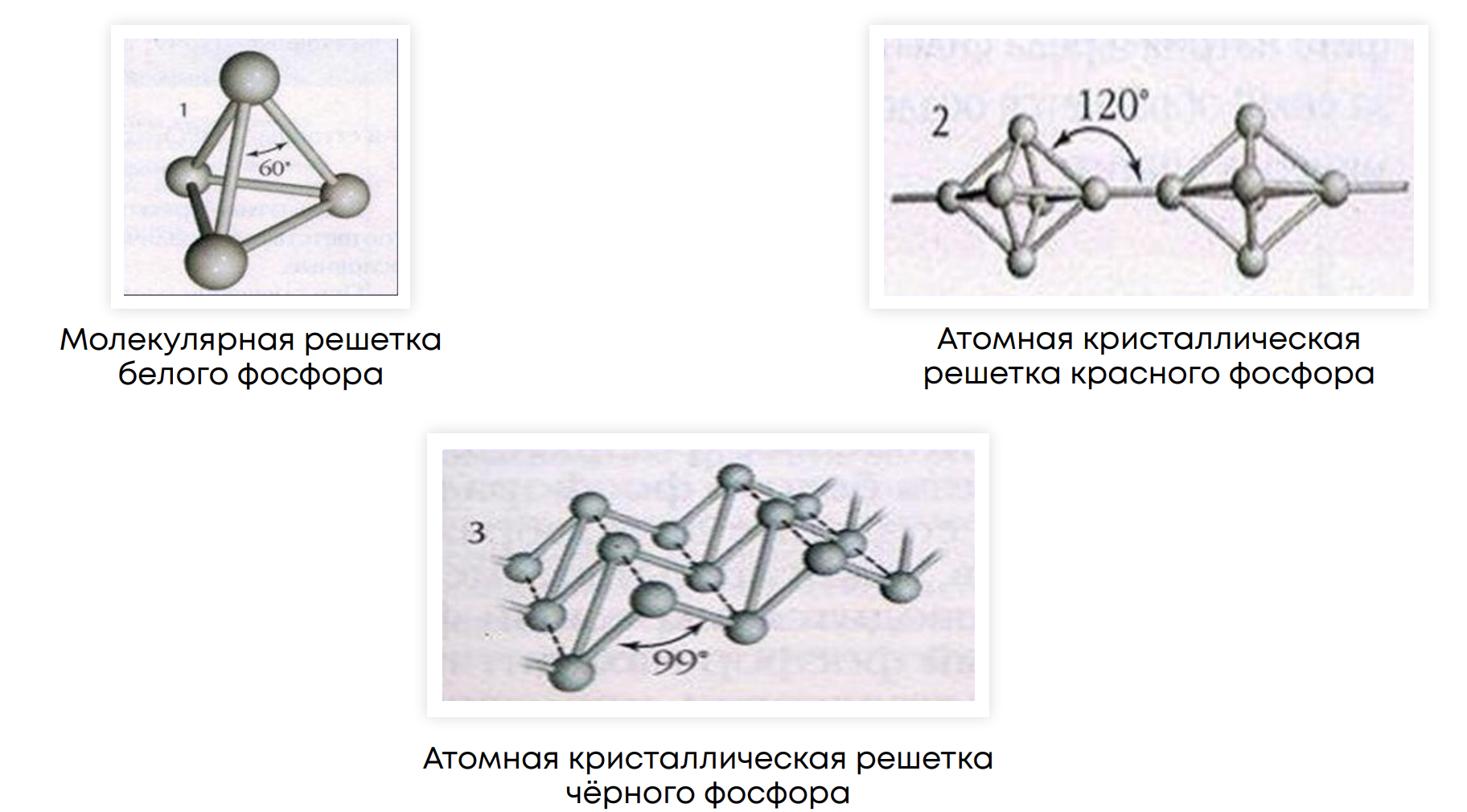
Физические свойства аллотропных модификаций:
Аллотропные переходы:

В природе фосфор входит в состав органических соединений и образует минералы-фосфаты (апатиты, фосфориты и др.).
Получение фосфора: белый фосфор получают из природных фосфатов, прокаливая их с коксом и песком в электрической печи.

Химические свойства:
1. Взаимодействует с активными и среднеактивными металлами:
Образует фосфиды (с.о. -3):
3Ca + 2P → Ca3P2
Фосфиды реагируют с водой и кислотами:
Ca3P2 + 6H2O → 3Ca(OH)2↓ + 2PH3↑
Ca3P2 + 6HCl → 3CaCl2 + 2PH3↑
2. С кислородом образуется триоксид или пентаоксид (избыток-недостаток):
4P + 3O2 → 2P2O3 – недостаток кислорода
4P + 5O2 → 2P2O5 – избыток кислорода
3. С серой при нагревании образует сульфид:
2P + 3S → P2S3
4. С галогенами в избытке и недостатке получаются разные продукты:
2P + 5F2 → 2PF5
2P + 3Cl2 → 2PCl3 – недостаток хлора
2P + 5Cl2 → 2PCl5 – избыток хлора
2P + 3Br2 → 2PBr3 – недостаток брома
2P + 5Br2 → 2PBr5 – избыток брома
2P + 3I2 → 2PI3
5. Взаимодействие с водой:
Без катализатора при высокой температуре:
4P + 6H2O → PH3↑ + 3H3PO2
С катализатором:
2P + 8H2O → 2H3PO4 + 5H2↑
6. Взаимодействие с щелочами:
Без нагрева:
4Р + 3KOH + 3Н2О → РН3↑ + 3KН2РО2
С нагревом:
4Р + 8KOH + 4Н2О → 4Н2↑ + 4K2НРО3
7. Реакции с кислотами-окислителями:
P + H2SO4 (конц.) → H3PO4 + SO2↑ + H2O
P + HNO3 (конц.) → H3PO4 + NO2↑ + H2O
P + HNO3 (разб.) + H2O → H3PO4 + NO↑
Применение: химическое оружие и в зажигательных снарядах (белый), производство спичек (красный)