Кислоты – соединения, распадающиеся на катион водорода и анион кислотного остатка
Физические свойства: при нормальных условиях большинство неорганических кислот – жидкости, некоторые – в твердом состоянии, например H3BO3, кислые на вкус

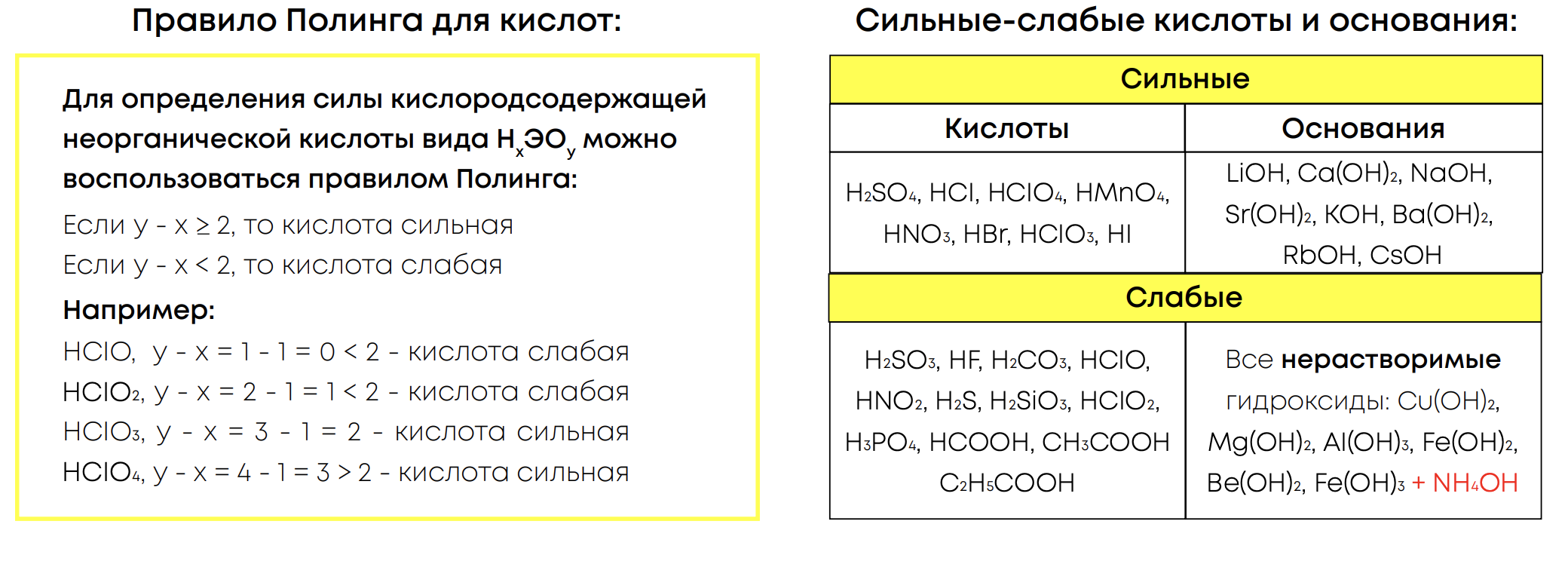
Сильные и слабые кислоты:
Химические свойства:
1. Диссоциация – слабые кислоты почти не диссоциируют:
HNO3 ⇄ H+ + NO3 –
2. С металлами – кислоты-неокислители реагируют с металлами левее Н в ряду активности:
Fe + 2HCl → FeCl2 + H2↑
Важно: кислоты-окислители (серная концентрированная и азотная) реагируют по-другому!
3. С основными и амфотерными оксидами может получится средняя/кислая соль:
ZnO + 2HCl → ZnCl2 + H2O
CuO + H2SO4 → CuSO4 + H2O
Na2O + 2H2SO4 → 2NaHSO4 + H2O – избыток кислоты
4. С основаниями и амфотерными гидроксидами (нейтрализация) может
получится средняя/кислая/основная соль:
NaOH + HCl → NaCl + H2O
Zn(OH)2 + H2SO4 → ZnSO4 + 2H2O
NaOH + H2SO4 → NaHSO4 + H2O – избыток кислоты
Ca(OH)2 + HCl → CaOHCl + H2O – избыток основания
5. С солями: средними, кислыми, основными: со средними реакция идёт, если образуется слабый электролит: газ, осадок, слабые кислоты:
H2SO4 + Na2SiO3 → Na2SO4 + H2SiO3↓
2HCl + Na2S → 2NaCl + H2S↑
2HCl + Na2CO3 → 2NaCl + CO2↑ + H2O
2HCl + Na2SO3 → 2NaCl + SO2↑ + H2O
CH3COOK + HCl → CH3COOH + KCl
AgNO3 + HCl → AgCl↓ + HNO3
Или может идти реакция с образованием кислой соли:
Na2CO3 + CO2 + H2O → 2NaHCO3
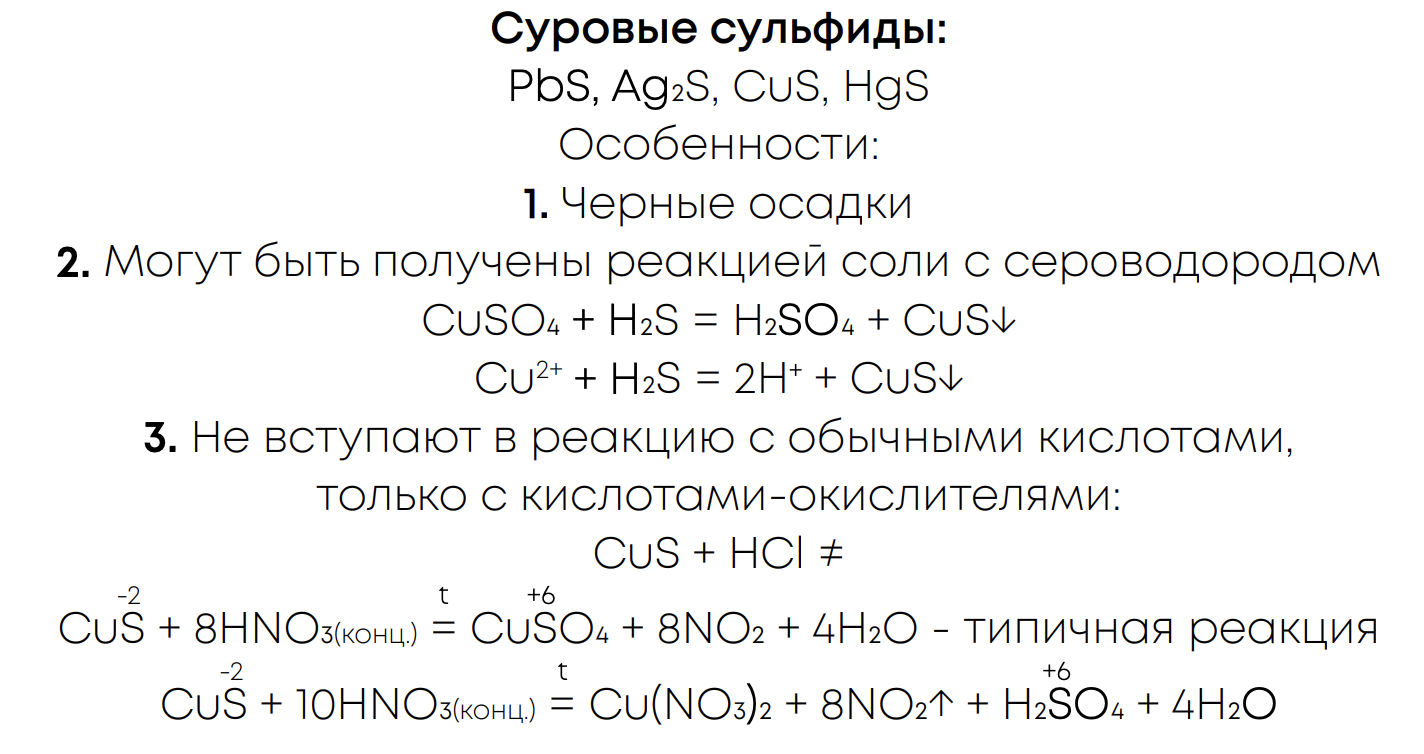
Какие соли нерастворимы в кислотах?
Чёрные сульфиды (HgS, Ag2S, PbS, CuS), AgCl, AgBr, AgI, BaSO4; но все, кроме BaSO4 и AgCl могут реагировать с кислотами – окислителями
6. Разложение:
2HCl ⇄ H2 + Cl2 – при нагревании
4HNO3 ⇄ 4NO2↑ + O2↑ + 2H2O – при нагревании, облучении
H2CO3 ⇄ CO2↑ + H2O – самопроизвольно
H2SO3 ⇄ SO2↑ + H2O – самопроизвольно
H2SiO3 → SiO2 + H2O – при нагревании
Специфические реакции:
1. Плавиковая кислота реагирует с кремнием и диоксидом кремния:
Si + 4HF → SiF4 + 2H2 – c газом или в недостатке кислоты
Si + 6HF → H2[SiF6] + 2H2↑ – с избытком кислоты
SiO2 + 4HF → SiF4 + 2H2O – с газом или в недостатке кислоты
SiO2 + 6HF → H2[SiF6] + 2H2O – с избытком кислоты
2. Галогеноводородные кислоты – замещение галогена более активным галогеном:
2HI + Br2 → 2HBr + I2↓
3. Взаимодействие с аммиаком:
NH3 + H2SO4 → NH4HSO4 – избыток кислоты
2NH3 + H2SO4 → (NH4)2SO4 – избыток аммиака
4. Реакции с H2S:
H2S + Br2 → 2HBr + S↓
H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl
2H2S + SO2 → 3S + 2H2O
5. Кислоты-окислители с особыми свойствами:
H2SO4 (конц.) и HNO3
