Серная кислота является окислителем только в концентрированном виде, в разбавленном – обычная сильная кислота:
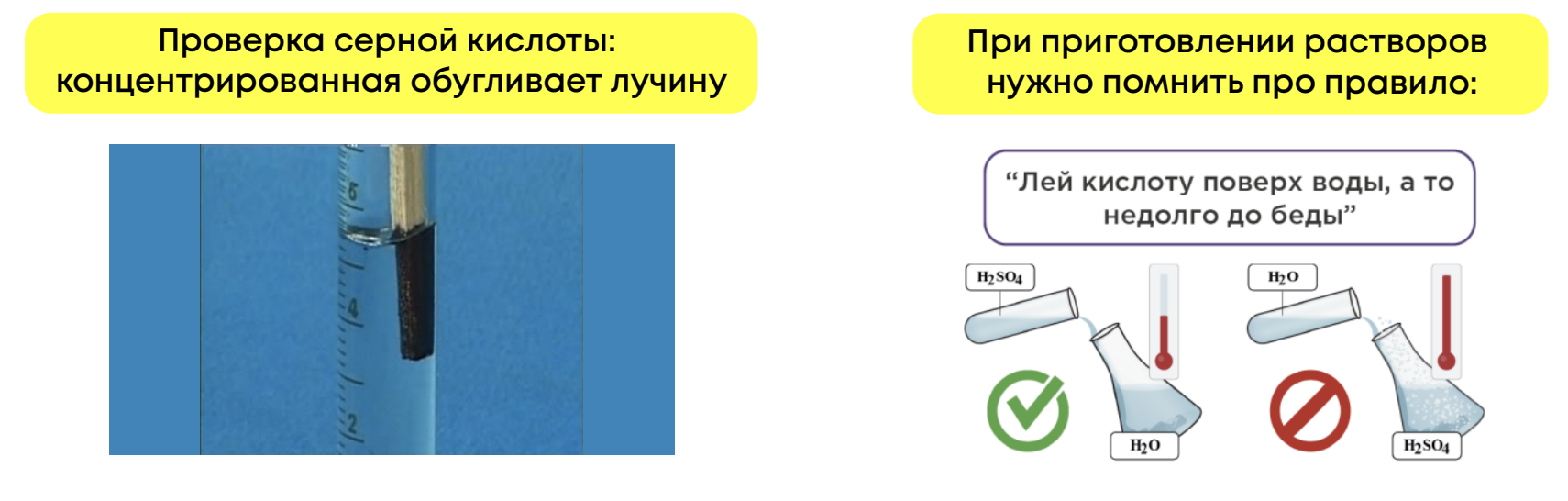
Физические свойства: тяжёлая маслянистая жидкость, нелетучая, сильная, гигроскопична (впитывает влагу), обугливает углеводы, растворима
Химические свойства:
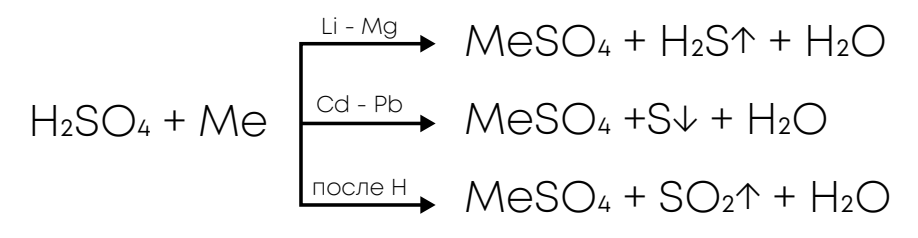
1. С металлами:
Пассивация: Al, Cr, Fe – не реагируют с конц. кислотой без нагрева, дают при нагреве SO2
Вообще не реагируют: Au, Pt
Пояснение: при реакции с цинком можно написать любые продукты, нужно опираться на контекст, т.к. реакция может идти по-разному в разных условиях
2. С неметаллами:
2S + H2SO4 → 3SO2↑ + 2H2O
C + 2H2SO4 → CO2↑ + 2SO2↑ + 2H2O
2P + 5H2SO4 → 2H3PO4 + 5SO2↑ + 2H2O
3. Со сложными веществами:
Cu2O + 3H2SO4 → 2CuSO4 + SO2↑ + 3H2O
2FeO + 4H2SO4 → Fe2(SO4)3 + SO2↑ + 4H2O
2Fe(OH)2 + 4H2SO4 → Fe2(SO4)3 + SO2↑ + 6H2O
2Fe3O4 + 10H2SO4 → 3Fe2(SO4)3 + SO2↑ + 10H2O
H2S + 3H2SO4 → 4SO2↑ + 4H2O
Cu2S + 6H2SO4 → 2CuSO4 + 5SO2↑ + 6H2O
CuS + 4H2SO4 → CuSO4 + 4SO2↑ + 4H2O
K2SO3 + H2SO4 → K2SO4 + SO2↑ + H2O
2FeS + 10H2SO4 → Fe2(SO4)3 + 9SO2↑ + 10H2O
KF + H2SO4 → KHSO4 + HF↑ – на твёрдую соль капают серной концентрированной кислотой, галогеноводород улетучивается
KCl + H2SO4 → KHSO4 + HCl↑ – на твёрдую соль капают серной концентрированной кислотой, галогеноводород улетучивается
2HBr + H2SO4 → Br2 + SO2↑ + 2H2O
8HI + H2SO4 → 4I2↓ + H2S↑ + 4H2O
2KBr + 3H2SO4 → 2KHSO4 + Br2 + SO2↑ + 2H2O
8KI + 5H2SO4 → 4KHSO4 + 4I2↓ + H2S↑ + 4H2O
P2O3 + 2H2SO4 + H2O → 2H3PO4 + 2SO2↑
PH3 + 4H2SO4 → H3PO4 + 4SO2↑ + 4H2O
Азотная кислота является кислотой-окислителем в любом виде:

Физические свойства: бесцветная, гигроксопичная жидкость с резким запахом, “дымит” – в концентрированном виде разлагается, сильная, растворимая, летучая (разлагается до газов)
Химические свойства:
1. С металлами:
Me + HNO3 → MeNO3 + NO2↑/NO↑/N2↑/N2O↑/NH4NO3 + H2O
Концентрированная кислота реагирует с образованием бурого газа NO2, разбавленная может давать разные продукты: NO↑/N2↑/N2O↑, зависит от условий, с очень разбавленной кислотой получается NH4NO3
Самое важное – запомнить реакцию малоактивных металлов с азотной кислотой:
Cu + 4HNO3 (конц.) → Cu(NO3)2 + 2NO2↑ + 2H2O
3Cu + 8HNO3 (разб.) → 3Cu(NO3)2 + 2NO↑ + 4H2O
Со другими веществами это правило работает: с концентрированной – NO2, а с разбавленной – NO
Пассивация: Al, Cr, Fe – не реагируют с конц. кислотой без нагрева, дают при нагреве NO2
Вообще не реагируют: Au, Pt

2. С неметаллами:
S + 6HNO3 (конц.) → H2SO4 + 6NO2↑ + 2H2O
S + 2HNO3 (разб.) → H2SO4 + 2NO↑
C + 4HNO3 (конц.) → CO2↑ + 4NO2↑ + 2H2O
3C + 4HNO3 (разб.) → 3CO2↑ + 4NO↑ + 4H2O
P + 5HNO3 (конц.) → H3PO4 + 5NO2↑ + H2O
3P + 5HNO3 (разб.) + 2H2O → 3H3PO4 + 5NO↑
I2 + 10HNO3 (конц.) → 2HIO3 + 10NO2 + 4H2O
3. Со сложными веществами:
FeO + 4HNO3 (конц.) → Fe(NO3)3 + NO2↑ + 2H2O
Fe3O4 + 10HNO3 (конц.) → 3Fe(NO3)3 + NO2↑ + 5H2O
3Cu2O + 14HNO3 (разб.) → 6Cu(NO3)2 + 2NO↑ + 7H2O
Fe(OH)2 + 4HNO3 (конц.) → Fe(NO3)3 + NO2↑ + 3H2O
H2S + 8HNO3 (конц.) → H2SO4 + 8NO2↑ + 4H2O
CuS + 10HNO3 (конц.) → CuSO4 + 8NO2↑ + 4H2O
Ag2S + 10HNO3 (конц.) → 2AgNO3 + H2SO4 + 8NO2↑ + 4H2O
K2SO3 + 2HNO3 (конц.) → K2SO4 + 2NO2↑ + H2O
PH3 + 8HNO3 (конц.) → H3PO4 + 8NO2↑ + 4H2O
3P2O3 + 4HNO3 (разб.) + 7H2O → 6H3PO4 + 4NO↑
SO2 + 2HNO3 (конц.) → H2SO4 + 2NO2↑
6HBr + 2HNO3 (разб.) → 3Br2 + 2NO↑ + 4H2O
2HI + 2HNO3 (конц.) → 2I2↓ + 2NO2↑ + 2H2O
HI + 6HNO3 (конц.) → HIO3 + 3NO2↑ + 3H2O
2KBr + 4HNO3 (конц.) → 2KNO3 + Br2 + 2NO2↑ + 2H2O
6KI + 8HNO3 (разб.) → 6KNO3 + 3I2↓ + 2NO↑ + 4H2O
KI + 6HNO3 (конц.) → KIO3 + 6NO2↑ + 3H2O
Важно: серная концентрированная и азотная кислоты, если реакция не принадлежит к классу ОВР, будут реагировать как и обычные кислоты
