Химические свойства средних солей:
1. Электролитическая диссоциация (хорошо диссоциируют растворимые соли):
KNO3 ⇄ K+ + NO3 –
2. С кислотами реакция идёт, если образуется слабый электролит (газ, осадок, вода, слабые кислоты):
H2SO4 + Na2SiO3 → Na2SO4 + H2SiO3↓
2HCl + Na2S → 2NaCl + H2S↑
2HCl + Na2CO3 → 2NaCl + CO2↑ + H2O
2HCl + Na2SO3 → 2NaCl + SO2↑ + H2O
CH3COOK + HCl → CH3COOH + KCl
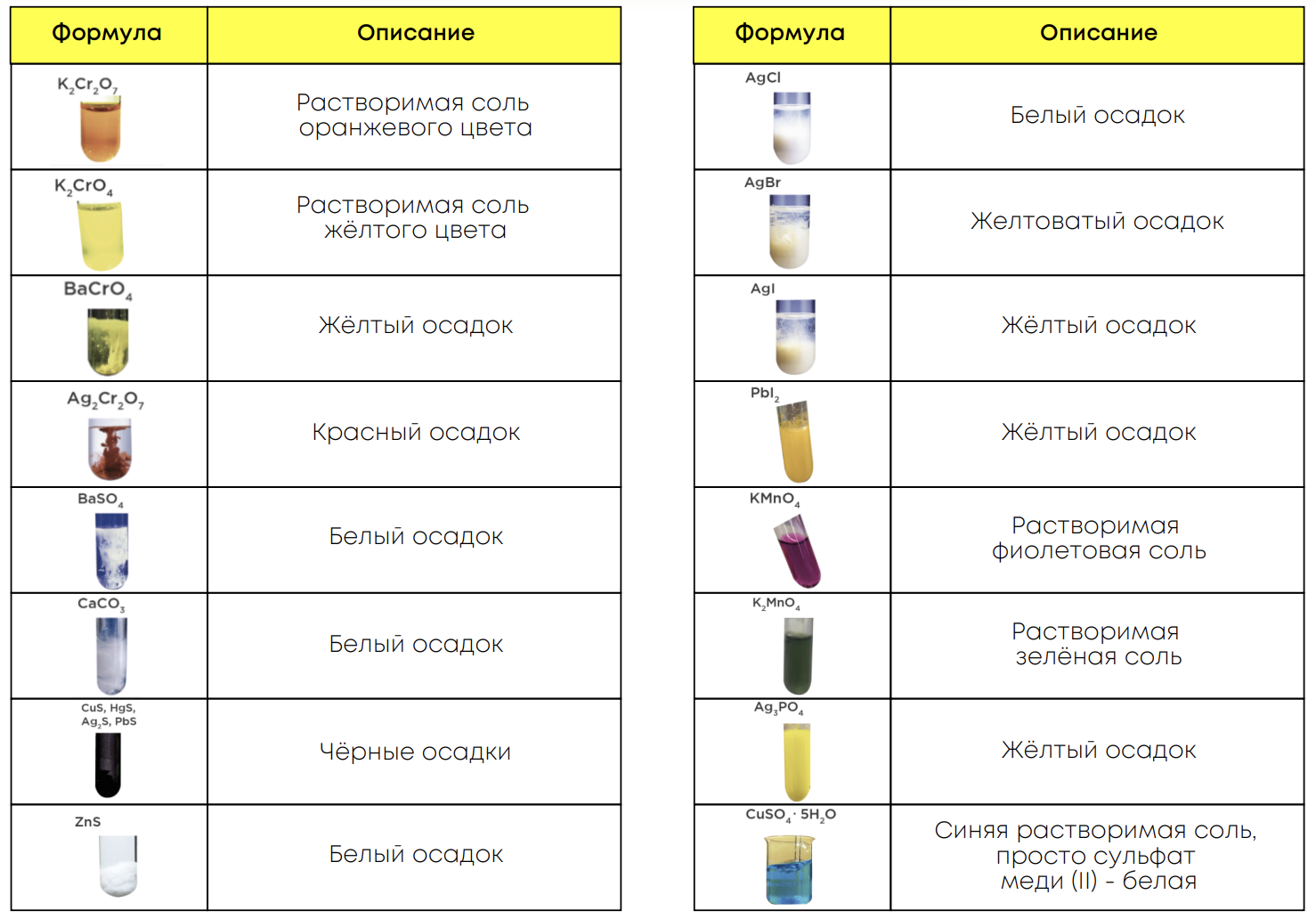
AgNO3 + HCl → AgCl↓ + HNO3
Или может идти реакция с образованием кислой соли:
Na2CO3 + CO2 + H2O → 2NaHCO3
3. С кислотными и амфотерными оксидами – замещение SO2 и СО2:
K2CO3 + SiO2 → K2SiO3 + CO2↑ – при сплавлении
K2SO3 + ZnO → K2ZnO2 + SO2↑ – при сплавлении
4. С щелочами – если соль растворима и есть признак реакции:
NH4Cl + NaOH → NaCl + NH3↑ + H2O
CuCl2 + 2NaOH → 2NaCl + Cu(OH)2↓
5. C солями – если соли растворимы и есть признак реакции:
CuCl2 + 2AgNO3 → Cu(NO3)2 + 2AgCl↓
6. С металлами – замещение более активным металлом:
CuCl2 + Fe → FeCl2 + Cu↓
Химические свойства кислых солей:
1. Электролитическая диссоциация (хорошо диссоциируют растворимые соли):
KHCO3 ⇄ K+ + HCO3 – – диссоциация большинства кислых солей
KHSO4 ⇄ K+ + H+ + SO4 2- – диссоциация гидросульфатов
2. С щелочами – до образования средней или менее кислой соли:
NaHCO3 + NaOH → Na2CO3 + H2O
NaH2PO4 + NaOH(нед.) → Na2HPO4 + H2O
3. С кислотами – если образуется слабый электролит:
NaHS + HCl → NaCl + H2S↑
Химические свойства основных солей:
1. Электролитическая диссоциация (хорошо диссоциируют растворимые соли):
MgOHCl ⇄ MgOH+ + Cl –
2. С кислотами – до образования средней или менее основной соли:
CaOHCl + HCl → CaCl2 + H2O
Al(OH)2Cl + HCl(нед.) → AlOHCl2 + H2O
3. Разложение малахита при нагреве:
(CuOH)2CO3 = 2CuO + H2O + CO2↑
Химические свойства солей амфотерных металлов:
1. Электролитическая диссоциация (хорошо диссоциируют растворимые соли):
K2[Zn(OH)4] ⇄ 2K+ + [Zn(OH)4] 2-
2. Разложение комплексов при нагревании:
Na[Al(OH)4] → NaAlO2 + 2H2O
3. Взаимодействие с кислотами:
K2[Zn(OH)4] + 4HCl → 2KCl + ZnCl2 + 4H2O – избыток кислоты
K2[Zn(OH)4] + HCl → KCl + Zn(OH)2↓ + H2O – недостаток кислоты
K2ZnO2 + 4HCl → 2KCl + ZnCl2 + 2H2O
4. Гидролиз средних солей:
KAlO2 + 2H2O → KOH + Al(OH)3↓
5. Взаимодействие комплексов с СО2 и SO2:
Na[Al(OH)4] + CO2 → NaHCO3 + Al(OH)3↓ – реакция с избытком кислотного оксида, в недостатке возможно образование карбоната
K2[Zn(OH)4] + 2SO2 → 2KHSO3 + Zn(OH)2↓ – реакция с избытком кислотного оксида, в недостатке возможно образование сульфита
6. Взаимодействие комплексов с H2S:
Na[Al(OH)4] + H2S → NaHS + Al(OH)3↓ + H2O – реакция с избытком сероводорода, в недостатке возможно образование сульфида
Na2[Zn(OH)4] + 3H2S → 2NaHS + ZnS↓ + 4H2O – реакция с избытком сероводорода, в недостатке возможно образование сульфида
Разложение:
1. Разложение нитратов при нагревании:
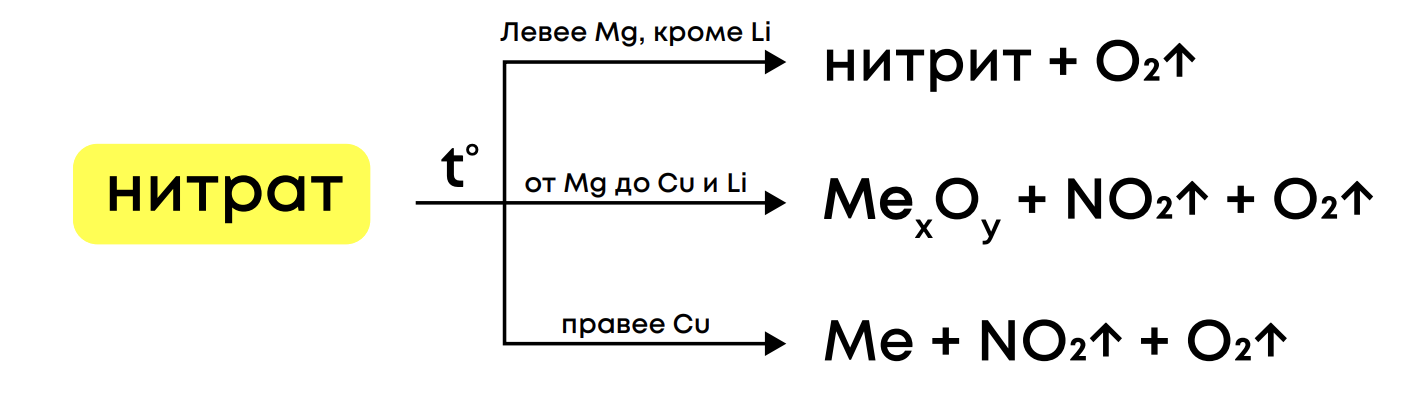
Коварные случаи:
4Fe(NO3)2 → 2Fe2O3 + 8NO2↑ + O2↑
Mn(NO3)2 → MnO2 + 2NO2↑
NH4NO2 → N2↑ + 2H2O
NH4NO3 → N2O↑ + 2H2O
2. Разложение других солей при нагревании:
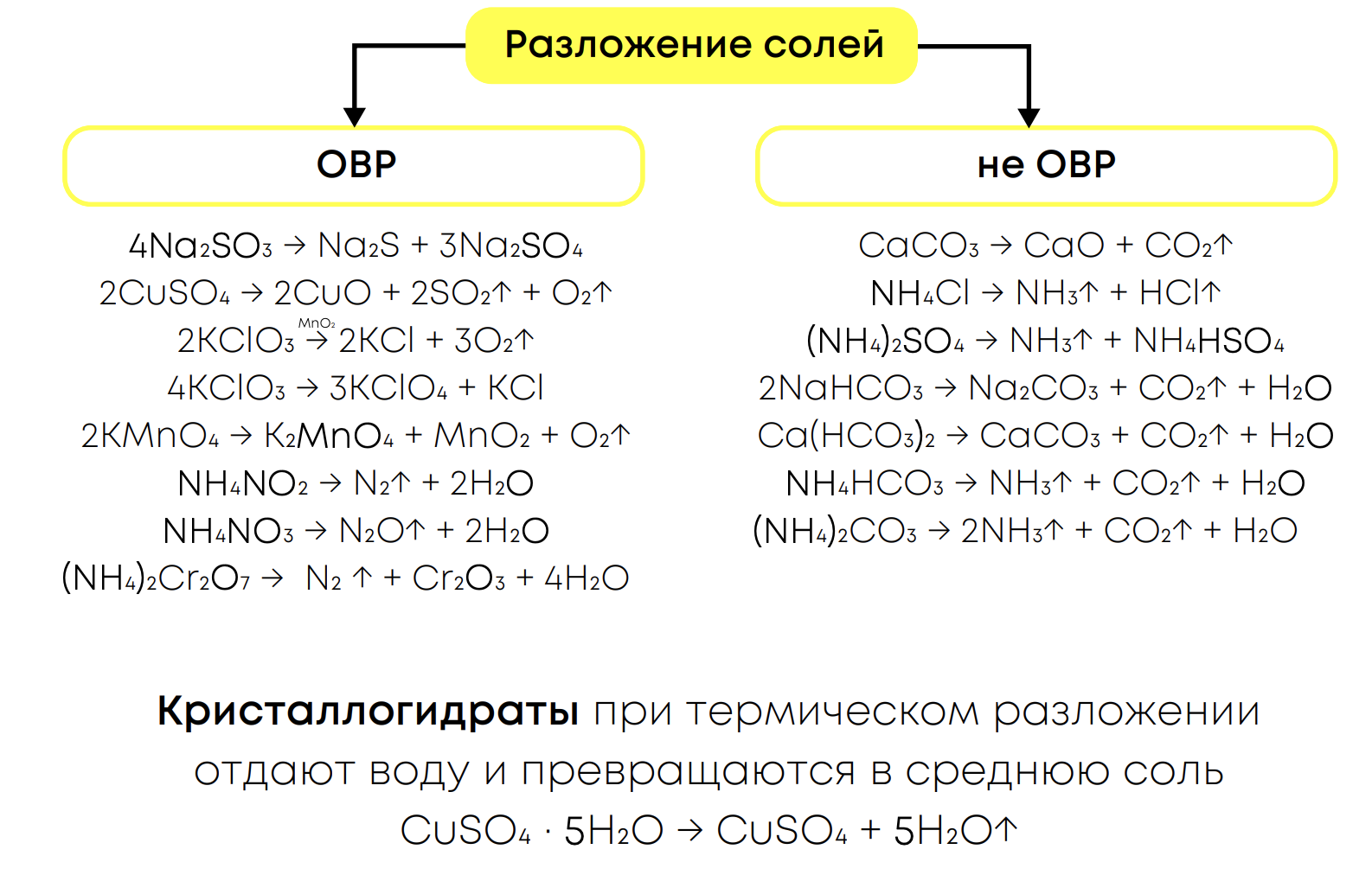
Специфические реакции:
1. Галогены могут вытеснить менее активные галогены:
2NaBr + Cl2 → 2NaCl + Br2
2. Бром и иод могут вытеснять серу из сульфидов:
K2S + Br2 → 2KBr + S
K2S + I2 → 2KI + S
3. Жёлтые хроматы переходят в оранжевые дихроматы в кислой среде:
2Na2CrO4 + H2SO4 → Na2Cr2O7 + Na2SO4 + H2O
Оранжевые дихроматы переходят в жёлтые хроматы в щелочной среде:
K2Cr2O7 + 2KOH → 2K2CrO4 + H2O

