Содержание этой главы, как и остальных глав со звёздочкой, напрямую не связано с ОГЭ. Но в некоторой степени нужно для более полного понимания и присутствует в школьной программе. Мне бы хотелось, чтобы ученик заранее столкнулся с электронной конфигурацией, ведь так или иначе её придётся изучить и понять.
Если взглянуть на строение электронной оболочки и атома в целом с последними знаниями, то придётся добавить парочку интересных вещей.
Основные тезисы модели атома Шрёдингера:
- Электрон обладает дуализмом: он и частица и волна
- Если электрон – волна, то он не движется как шарик по орбиталям вокруг ядра
- Нахождение электрона может быть описано полем вероятности его нахождения
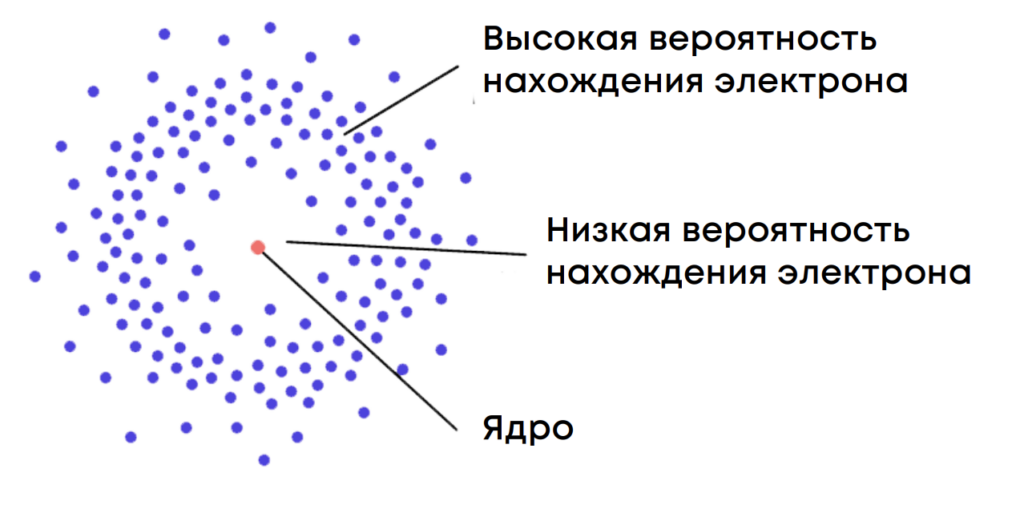
Представьте, что электрон – это волна, которая «размазывается» вокруг ядра, т.е. у него нет одной четкой локации. И есть некая область вокруг ядра, где вероятность найти электрон высока. Эта область и называется электронным облаком!
Но в электронном облаке вероятность встретить электрон неравномерна: есть участки, где она выше. Такие части электронного облака называются атомной орбиталью.
Атомная орбиталь – область пространства наиболее вероятного нахождения электрона в электронном облаке атома с определённой формой
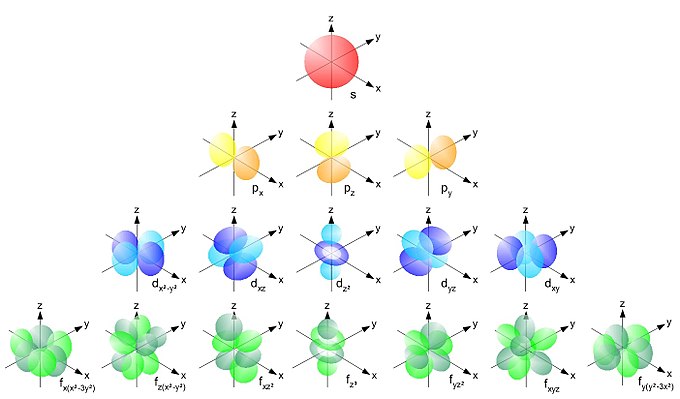
Атомные орбитали отличаются друг от друга по форме:
s-орбитали имеют самую простую форму – сферическую, на каждом энергетическом уровне может быть лишь 1 такая орбиталь
p-орбитали имеют форму объёмной восьмёрки или гантели, из-за более сложной формы они могут располагаться тремя различными способами по трём осям и их в каждом энергетическом уровне 3 штуки
d-орбитали имеют ещё более сложную форму и их помещается на каждом энергетическом уровне 5 штук
f-орбитали ещё более разнообразны и на одном энергетическом уровне может быть 7 таких
При удалении от ядра увеличиваются энергия и размер орбитали, а также энергия электрона на ней. При этом на одной орбитали может находиться максимум 2 электрона. Выделим три вида орибталей: вакантная – 0 электронов, полузаполненная – 1 электрон, заполненная – 2 электрона.
Одинаковые орбитали объединяются в энергетические подуровни: s-подуровень вмещает 1 s-орбиталь, p-подуровень вмещает 3 p-орибитали, d-подуровень – 5 d-орбиталей, а f-подуровень – 7 f-орбиталей.
Энергетический подуровень – совокупность одинаковых орбиталей одного энергетического уровня, «подслой» в энергетическом уровне
Так что же такое электронная конфигурация? Это детальное строение электронной оболочки атома, учитывая все эти подуровни и орбитали.
Энергетические подуровни заполняются по энергетическому принципу: сначала заполняется подуровень с наименьшей энергией. Также это правило называется правилом Клечковского или принципом Ауфбау.
Порядок заполнения можно выразить в виде красивой схемы:

Для построения электронных формул, которые отображают электронную конфигурацию, нужно запомнить этот порядок. Но мне кажется, что запомнить её будет не так уж и просто. Поэтому мы можем запомнить только начало в виде такого обрывка:

Чтобы записать электронную формулу:
1. Определяем количество электронов в атоме по номеру элемента
2. Записываем нашу электронную формулу по правилу Клечковского
3. Обрываем формулу по количеству электронов в индексах формулы (так чтобы сумма индексов была равна количеству электронов)
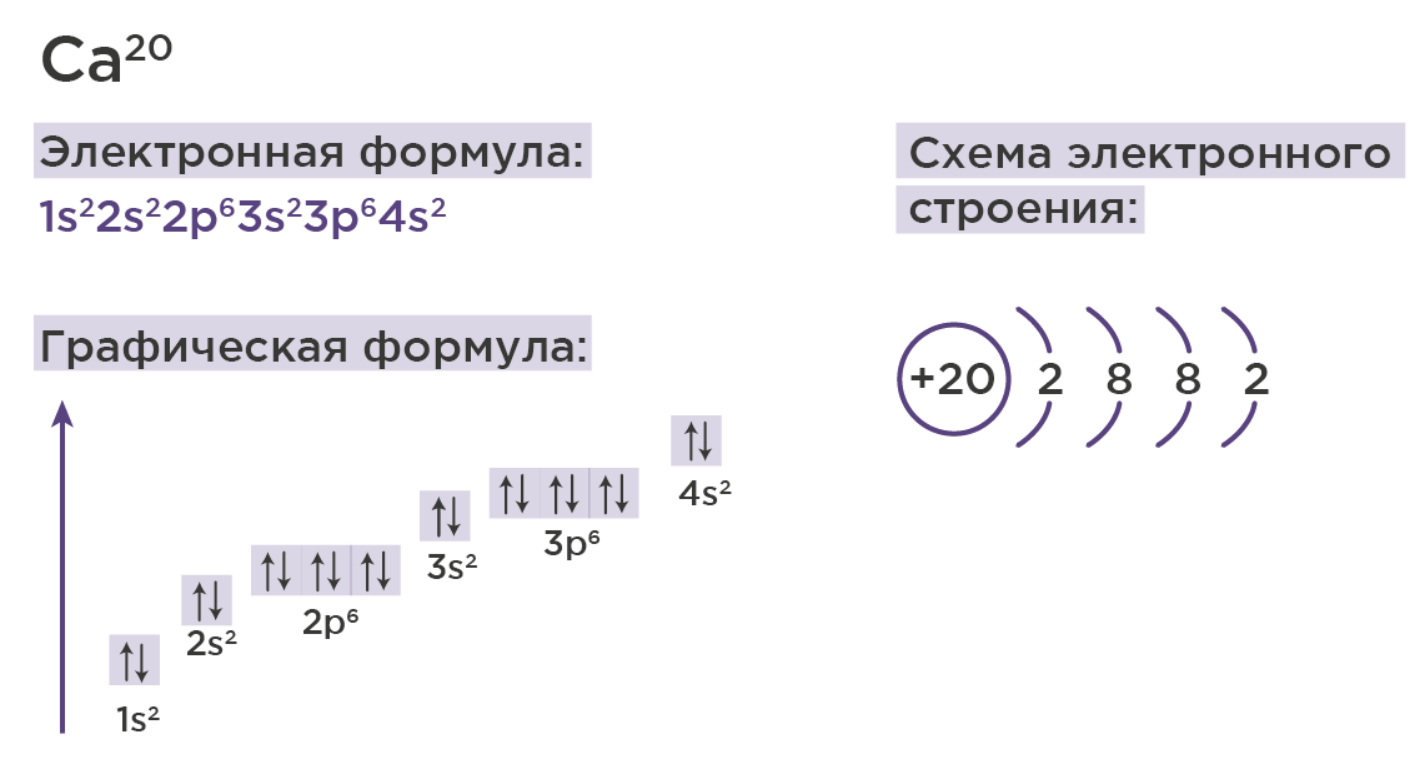
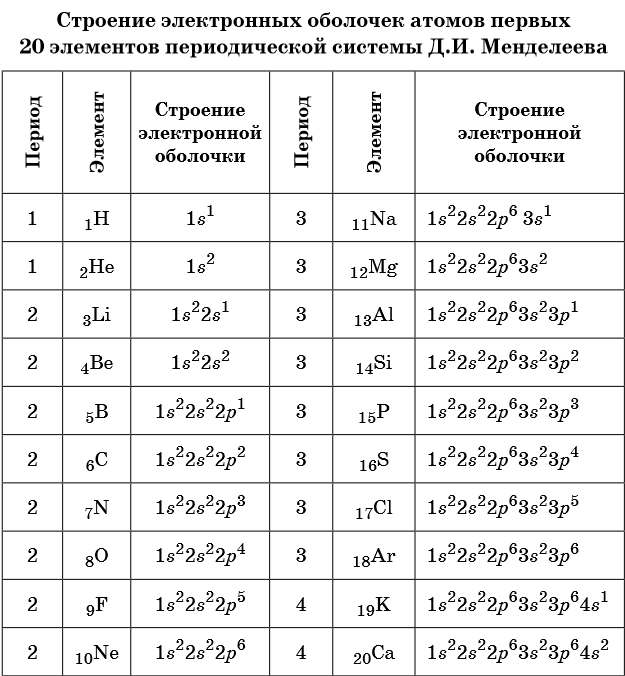
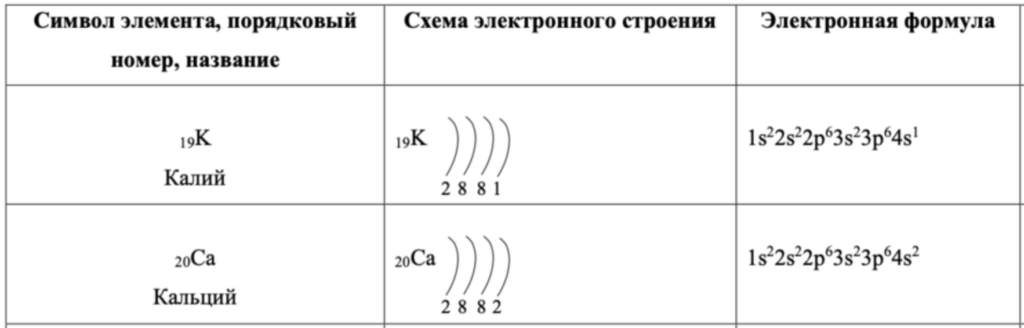
И у нас должны получится вот такие формулы: большие цифры означают номер энергетического уровня, маленькие в индексе сверху – количество электронов на подуровне, а буквы – тип подуровня.
Когда мы научились записывать электронные формулы, мы также можем зарисовать схему строения атома:
1. Рисуем в центре ядро и показываем его заряд (+номер элемента)
2. Рисуем электронные слои (количество равно номеру периода)
3. Показываем сколько электронов суммарно находится на каждом слое, для этого нужно сложить индексы подуровней слоя из электронной формулы
Но не всегда правило заполнения соблюдается, есть и исключения из правил – атомы с проскоком (провалом) электрона. Он наблюдается у многих элементов, но для школьной программы хватит запомнить и двух: медь и хром.
Проскок (провал) электрона – это переход электрона с более высокого на более низкий энергетический уровень против правила Клечковского
Наблюдается у: Cr, Cu, Nb, Mo, Ru, Rh, Pd, Ag, Pt, Au


Помимо электронной формулы и схемы строения атома, существует третий способ записи электронной конфигурации – энергетическая диаграмма или графическая формула.
Энергетическая диаграмма (графическая формула атома) – запись, показывающая электронную конфигурацию атома более подробно: с орбиталями и их заполнением
Правила составления диаграмм:
Чтобы записать энергетическую диаграмму по электронной формуле, необходимо изобразить орбитали в виде квадратиков с повышением наверх с возрастанием энергии электронов.
Далее «рассадить» электроны в виде стрелок (спинов) в окошки орбиталей в соответствии с принципом Паули и правилом Хунда.
Принцип Паули: в одном окошке-орбитали может поместиться максимум 2 электрона с противоположными стрелками-спинами
Правило Хунда: при заполнении p-d-f-подуровней сначала рассаживаем в каждое пустое окошко по одному электрону, далее когда пустых нет добавляем им пару

Пример для алюминия:
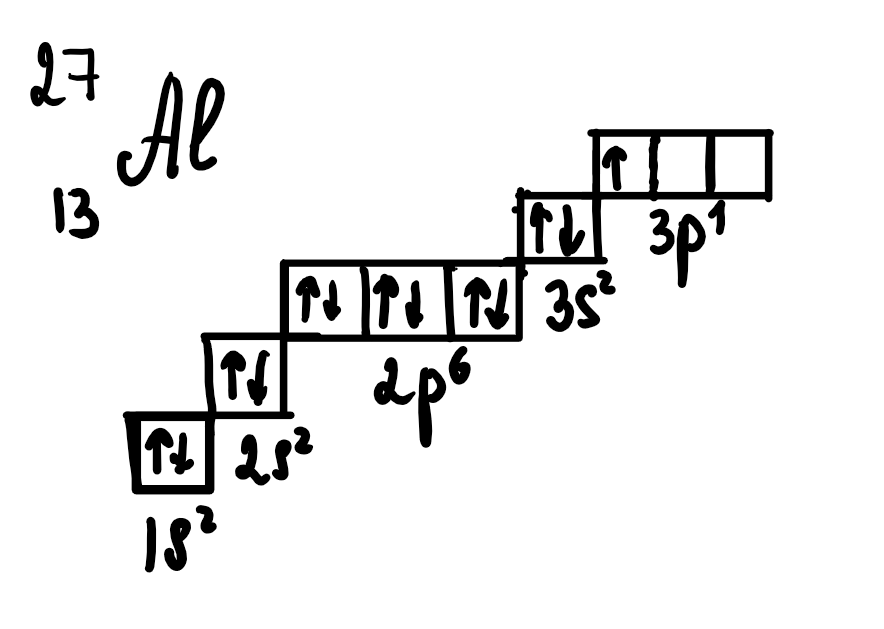
Мы видим, что с повышением энергии подуровни поднимаются чуть выше. В каждом подуровне есть орбитали, изображенные квадратиком, а внутри них – спаренные и неспаренные электроны.