В этой главе речь пойдёт про таблицу Менделеева, хотя правильнее называть её Периодической системой химических элементов (ПСХЭ) – фундамента современной химии.
Когда с развитием науки было открыто множество химических элементов, встал вопрос о их систематизации. Было предпринято много попыток, например таблица Джона Ньюлендса, который также разделял элементы на 8 групп («закон октав»):

Но лучше всего справился с этим наш Дмитрий Иванович Менделеев. Его классификация была самой правильной с точки зрения строения атома.
Менделеев сделал много удивительных вещей: расположил элементы согласно строению их атома (когда о его строении было мало что известно), оставил пустые места в ПСХЭ для ещё неоткрытых элементов и даже смог описать их свойства. И всё это, основываясь на анализе свойств элементов!
По сути, ПСХЭ – это графическое выражение простой, но фундаментальной закономерности – Периодического закона:
«Свойства химических элементов и их простых веществ, а также их соединений лежат в периодической зависимости от их порядкового номера»
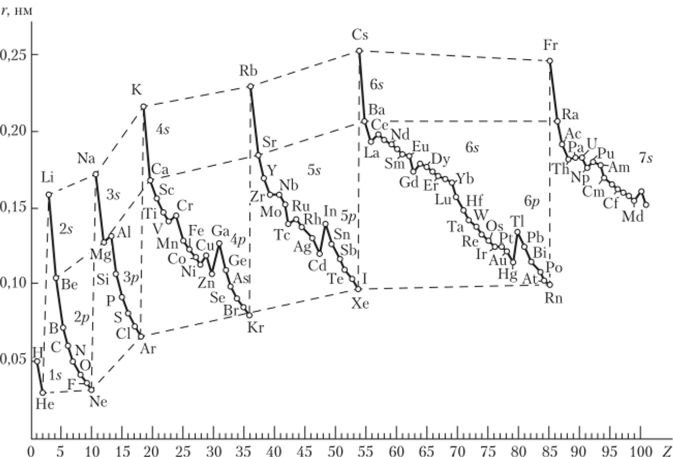
Периодичность изменения свойств – это цикличность, то есть постоянное повторение свойств через какой-то промежуток элементов. Например, вот как наглядно выглядит зависимость изменения радиуса атома от порядкового номера:
На сегодняшний день есть две основные версии ПСХЭ: более старая короткопериодная (используется в школе) и более новая и правильная широкопериодная.
В короткопериодной версии выделены 8 групп элементов, есть побочные и главные подгруппы, что делает изменение свойств между главными и побочными подгруппами в ней неравномерным.
Версия короткопериодной ПСХЭ для ОГЭ и ЕГЭ:
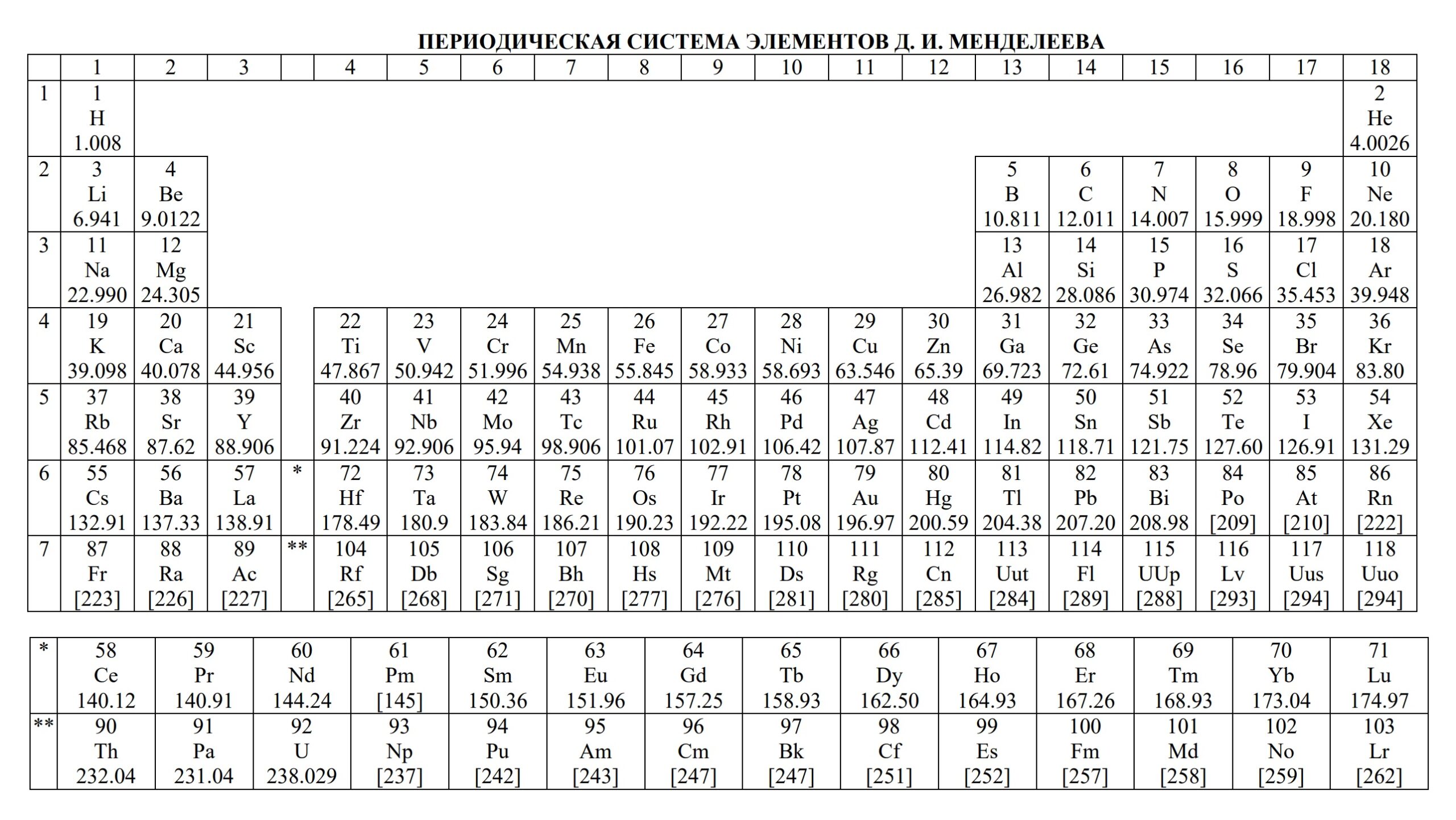
 Широкопериодная ПСХЭ является междунарондной, используется в олимпиадах и ВУЗах. В ней мы можем найти 18 групп, уже нет побочных и главных подгрупп (побочные элементы вставлены в середину с 3 по 12 группы) и свойства элементов изменяются более плавно.
Широкопериодная ПСХЭ является междунарондной, используется в олимпиадах и ВУЗах. В ней мы можем найти 18 групп, уже нет побочных и главных подгрупп (побочные элементы вставлены в середину с 3 по 12 группы) и свойства элементов изменяются более плавно.
Версия широкопериодной ПСХЭ:
Классификация элементов в ПСХЭ:
Металлы – элементы, которые обладают хорошей способностью к отдаче электронов и образуют простые вещества-металлы
Неметаллы – элементы, которые обладают хорошей способностью к принятию электронов и образуют простые вещества-неметаллы
Благородные (инертные) газы – элементы, которые имеют законченный внешний электронный уровень и практически не вступают в реакции (инертны), образуют простые вещества в виде одноатомных газов – в школе их относят к неметаллам
P.S. Иногда в литературе попадаются ещё и полуметаллы (металлоиды) – элементы провляющие свойства и металлов и неметаллов, но четкого понимания кто к ним относится нет
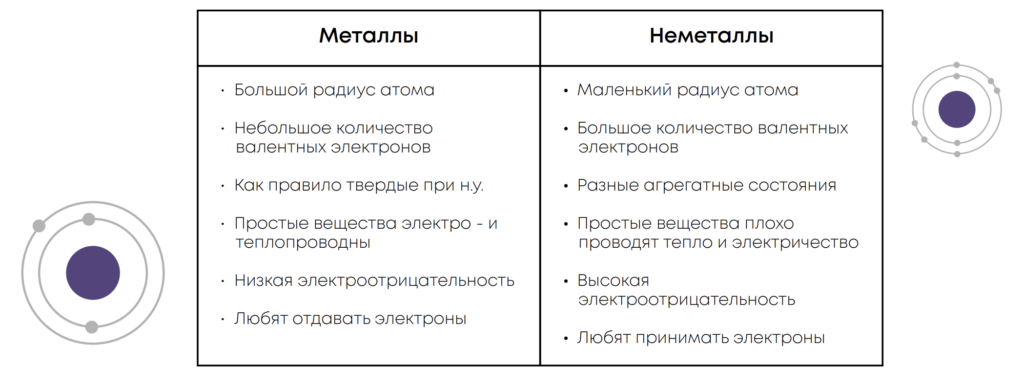
Металлов в ПСХЭ гораздо больше неметаллов, чтобы разделить металлы и неметаллы в нашей черно-белой таблице в школе предлагают провести линию от бора к астату: слева окажутся металлы, справа – неметаллы. Но этот способ недостаточно точный, поэтому предлагаю разделить их методом лесенки (закрашены красным неметаллы):

В ПСХЭ также есть разделение на группы и периоды, которое мы встречали ранее. А каждая подгруппа в короткопериодной таблице подразделяется на подгруппы: главную (А) и побочную (В).
Период – это горизонтальная строка в ПСХЭ, номер периода означает количество электронных слоёв (или энергетических уровне) в атоме; есть большие и малые периоды, которые содержат разное количество строк элементов
Группа – это вертикальный столбец в ПСХЭ, номер группы означает количество внешних (валентных) электронов, высшую степень окисления
Главная подгруппа (А) содержит s/p-элементы
Побочная подгруппа (B) содержит d-элементы, которые называют переходными (побочными) металлами
s-элементы
IA и IIA подгруппы (также H и He), конфигурация заканчивается на s-подуровне
p-элементы
IIIA – VIIIA подгруппы, конфигурация заканчивается на р-подуровне
d-элементы
Элементы побочных подгрупп, конфигурация заканчивается на d-подуровне
f-элементы
Лантаноиды и актиноиды, которые отдельно вынесены снизу, конфигурация заканчивается на f-подуровне
Элементы главной и побочной подгруппы одной группы сильно отличаются друг от друга по свойствам и электронному строению, поэтому их разделяют.
Как выделить главные подгруппы в ПСХЭ?
Обратите внимание на элементы второго периода, все значки, что располагаются на одной стороне с ними – главные подгруппы, всё остальное – побочные.
Названия главных подгрупп:
IA – щелочные металлы: Li, Na, K и др.
IIA – щелочноземельные металлы: Be, Mg, Ca и др.
IIIA – подгруппа бора: B, Al, Ga и др.
IVA – подгруппа углерода: C, Si, Ge и др.
VA – пниктогены: N, P, As и др.
VIA – халькогены: O, S, Se и др.
VIIA – галогены: F, Cl, Br и др.
VIIIA – инертные (благородные) газы: He, Ne, Ar и др.
Важные свойства химических элементов:
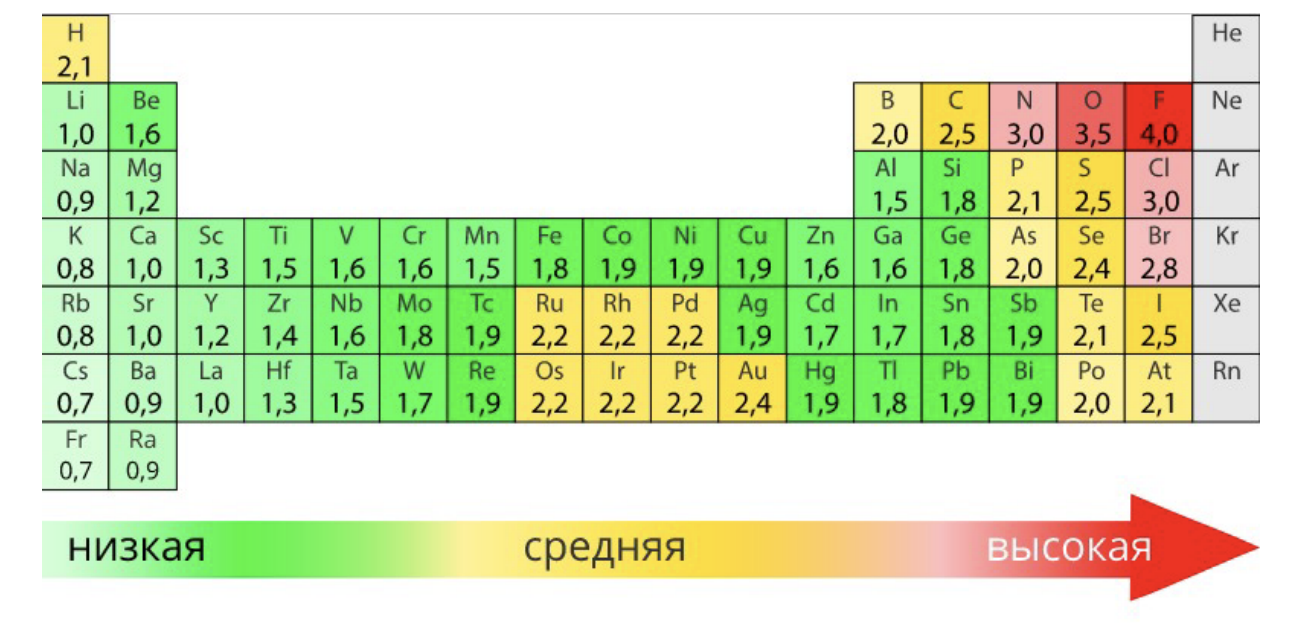
Электроотрицательность – “жадность до электронов”, способность атома смещать к себе электроны других элементов, если она высокая – атом стремится приобретать электроны, если низкая – отдавать (самая большая у фтора, увеличивается к нему)
Металлические (восстановительные) свойства – способность атома отдавать электроны и повышать свою степень окисления, объясняет физические свойства металлов
Неметаллические (окислительные) свойства – способность атома принимать электроны и понижать свою степень окисления, противоположны металлическим
Пожалуй, самое важное для ОГЭ – запомнить как изменяются свойства элементов и их соединений по таблице. Для этого я составил для вас шпаргалку ниже. Слева – то, как меняются свойства по периоду (влево-вправо), справа – то, как меняются по группе (вверх-вниз). Направление стрелки означает усиление/увеличение по свойствам.
Изменение свойств элементов и их соединений по ПСХЭ
(стрелками показано усиление-увеличение)

Летучие водородные соединения – бинарные соединения неметаллов с водородом, где неметалл проявляет низшую степень окисления, а водород проявляет степень окисления +1
Высшие оксиды – оксиды, в которых элементы находятся в своей высшей степени окисления
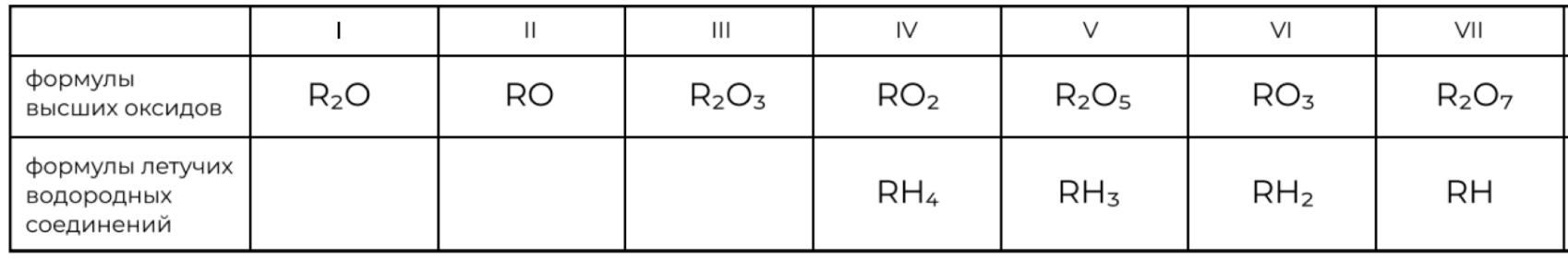
P.S. Высшая степень окисления равна номеру группы N; низшая степень окисления для неметалла равна N – 8 (у металлов низшая – 0, не может быть отрицательной)