Относительная атомная масса – безразмерная физическая величина, отношение массы атома к 1/12 атомной массы изотопа углерода; атомную массу любого элемента можно найти в ПСХЭ рядом с символом элемента (измеряется в атомных единицах массы – а.е.м. или дальтонах – Да)
Важно: атомная масса всегда округляется до целых, кроме атомной массы хлора, которая округляется до десятых (Ar(Cl) = 35,5 а.е.м.)
Атомная масса получается дробной из-за существования атомов элемента с разной массой – изотопов, которые имеют разное число нейтронов в ядре. Поэтому атомная масса, которую мы видим в ПСХЭ – средневзвешенное число, учитывающая вес изотопов и частоту их встречаемости. У радиоактивных и очень редких элементов принято обозначать массу самого стабильного изотопа.
Молекулярная масса (не путать с молярной) – безразмерная физическая величина, отношение массы молекулы или формульной единицы к 1/12 атомной массы углерода; молекулярную массу вещества легко посчитать по формуле вещества, сложив атомный вес каждого элемента в ней
Пример: рассчитаем молекулярную массу серной кислоты
Mr(H2SO4) = Ar(H)∙2 + Ar(S) + Ar(O)∙4 = 1∙2 + 32 + 16∙4 = 98 а.е.м.
Часто можно увидеть на многих растворах какие-то цифры, показывающие проценты. Например, уксусная кислота – раствор уксуса 9%. Но что это значит? Это называется массовой долей, и в случае уксуса мы можем сказать что масса самой уксусной кислоты занимает 9% от массы всего раствора (уксусная кислота + вода). Массовую долю часто используют, чтобы показать сколько масса чего-то занимает в чём-то.
Массовая доля – отношение массы части объекта к его общей массе, можно выразить в процентах или десятичных долях
С помощью массовой доли мы можем показать сколько масса какого-то конкретного элемента составляет от массы вещества, образованного элементом.
Формула массовой доли элемента в соединении:
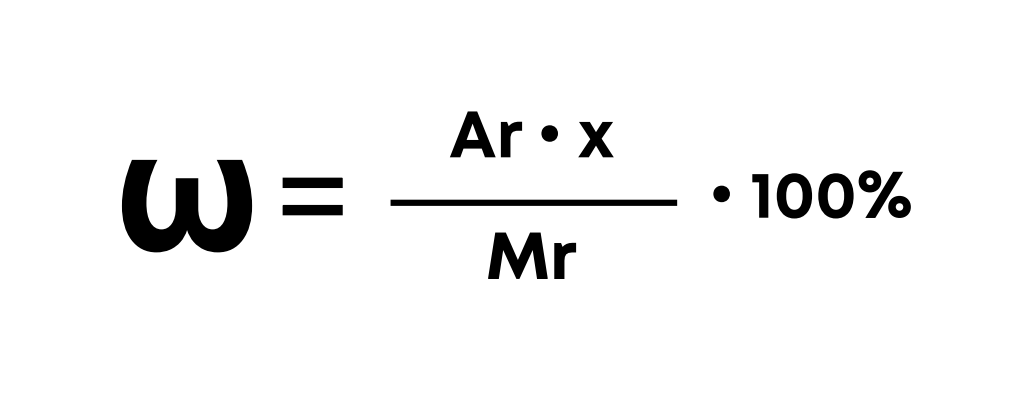
ω – массовая доля элемента в соединении, %
Ar – относительная атомная масса элемента, а.е.м.
x – количество атомов элемента в соединении
Mr – молекулярная масса соединения, а.е.м.
P.S. Если не домножать в формуле на 100%, то мы получим ответ не в процентах, а в десятичных долях (так массовую долю тоже иногда выражают)
Задача 1. Чему равна массовая доля кислорода в серной кислоте H2SO4?
1) Вычислим молекулярную массу серной кислоты:
Mr(H2SO4) = Ar(H)∙2 + Ar(S) + Ar(O)∙4 = 1∙2 + 32 + 16∙4 = 98 а.е.м.
2) Подставим данные в формулу:
ω(O) = Ar(O)∙4 : Mr(H2SO4)∙100% = 16∙4 : 98∙100% = 65,3%
Зная массовую долю мы можем из массы элемента найти массу вещества или же из массы вещества найти массу элемента. Выразим это в виде двух интересных формул:

Задача 2. Масса серной кислоты равна 1000 г. Чему равна масса кислорода, который содержится в серной кислоте?
1) Подставим уже вычисленную выше массовую долю кислорода в серной кислоте в формулу нахождения массы элемента:
m(O) = m(H2SO4)∙ω : 100% = 1000 г∙65,3% : 100% = 653 г
Задача 3. Масса кислорода в серной кислоте равна 500 г. Чему равна масса серной кислоты?
1) Подставим уже вычисленную выше массовую долю кислорода в серной кислоте в формулу нахождения массы вещества:
m(H2SO4) = m(O)∙100% : ω = 500 г∙100% : 65,3% = 765,7 г



