Мы с вами уже начали разбирать формулы для решения задач и в прошлой главе обсудили массовую долю вещества в растворе. В этой главе мы продолжим разбирать оставшиеся формулы, которые могут пригодиться при решении задач на ОГЭ.
Важное понятие в химии – количество вещества, т.е. количество частиц в какой-то части вещества. Количество частиц даже в паре граммов вещества может быть очень большим, поэтому для удобства количество частиц измеряют в одинаковых порциях. Одна такая порция называется моль и содержит определенное количество частиц.
Количество вещества – физическая величина, характеризующая количество однотипных структурных единиц, содержащихся в веществе (под структурными единицами понимаются любые частицы, из которых состоит вещество: атомы, молекулы, ионы, электроны или любые другие частицы)
В 1 моль любого вещества содержится 6,022∙1023 штук частиц, такое точное число называется постоянной/числом Авогадро и обозначается как NA. Отсюда мы можем вывести формулу, которая помогает связать количество частиц в порции вещества и количество моль в ней.
Формула количества вещества:
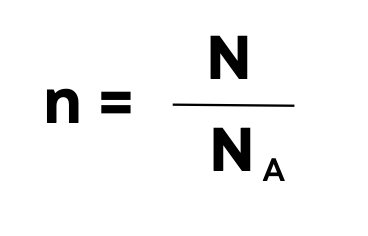
n – количество вещества, моль
N – количество частиц (по сути в штуках)
NA – число/постоянная Авогадро – 6,022∙1023 моль-1
Задача 1. Какое количество вещества содержится в 12∙1023 оксида углерода (IV)?
1) Подставим значение в формулу:
n(CO2) = N : NA = 12∙1023 : 6,022∙1023 ≈ 2 моль
Задача 2. Какое число молекул содержится в 2,5 моль кислорода?
1) Выразим из формулы количество частиц N:
N = n∙NA
2) Подставим значения в формулу:
N(О2) = n∙NA = 2,5∙6,022∙1023 = 15,055∙1023 ≈ 15∙1023
Следующее понятие, которое однозначно пригодится при решении задач – молярная масса М, физический смысл которой – масса 1 моль вещества. Часто молярную массу путают с молекулярной массой Mr, но они имеют разный физический смысл (масса 1 моль вещества и масса 1 молекулы вещества), хотя и численно равны (но имеют разную размерность).
Пример: молекулярная масса серной кислоты рассчитывается как масса всех атомов в формуле вещества и равна 98 а.е.м., а молярная масса серной кислоты равна 98 г/моль.
Молярная масса – это масса одного моля вещества, которая численно равна молекулярной массе, но измеряется в других единицах – г/моль
P.S. У солей нет молекул из-за ионного строения, формула соли – форульная единица ионного кристалла (тут молекулами называют для упрощения)
Формула молярной массы:
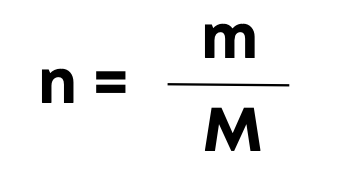
n – количество вещества, моль
m – масса вещества, г
M – молярная масса вещества, г/моль (вычисляется по формуле вещества идентично молекулярной)
Задача 3. Имеется 3 моль кислорода О2, определите массу кислорода.
1) Выразим из формулы массу вещества:
m = n∙M
2) Подсчитаем молярную массу кислорода по формуле и атомной массе из ПСХЭ:
M(О2) = 2Ar(O) = 16∙2 = 32 г/моль
3) Подставим в формулу и вычислим массу кислорода:
m(О2) = n∙M = 32∙3 = 96 г
Задача 4. Имеется 10 г водорода Н2, определите количество вещества водорода.
1) Выразим из формулы количество вещества:
n = m : M
2) Подсчитаем молярную массу водорода:
M(Н2) = 2Ar(Н) = 2∙1 = 2 г/моль
3) Подставим значения в формулу и вычислим количество вещества:
n(Н2) = m : M = 10 : 2 = 5 моль
Когда-то итальянский учёный Амадео Авагадро изучал газы и выявил интересный закон:
«В равных объёмах при одинаковых условиях (температура и давление) содержится одинаковое число частиц»
Из этого закона следует несколько следствий:
Следствие 1:
1 моль любого газа при нормальных условиях (н.у.) занимает молярный объём равный 22,4 л
Нормальные условия – это определенная температура 0ºС и давление 1 атмосфера, при которых объём 1 моль газа принимает именно такое значение
Следствие 2:
Объёмы реагирующих и образующихся газов при одинаковых условиях пропорциональны коэффициентам в уравнении реакцииРеакция:
Н2(газ) + Cl2(газ) = 2HCl(газ)
Объёмы газов:
V(Н2) = 1 л
V(Cl2) = 1 л
V(HCl) = 2 л
Формула молярного объёма (только для газов при н.у.):
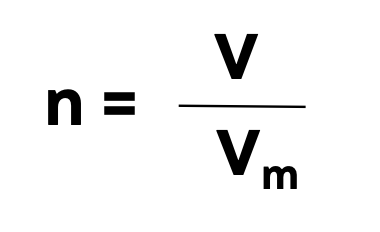
n – количество вещества, моль
V – объём газа, л
Vm – молярный объём – 22,4 л/моль
Задача 5. Определите объем (н. у.), который займут 0,25 моль водорода.
1) Перестроим формулу и выразим объём газа:
V = n∙Vm
2) Подставим значения в формулу:
V(Н2) = n∙Vm = 0,25∙22,4 = 5,6 л
Задача 6. Имеется 56 л хлора Сl2 при н.у., определите количество вещества хлора.
1) Подставим значение в формулу:
n(Cl2) = V : Vm = 56 л : 22,4 л/моль = 2,5 моль



