Поговорим о решении химических задач в 22 задании ОГЭ по химии. В целом могу сказать, что задачи в ОГЭ достаточно однотипные и простые и бояться их точно не стоит. Решаются такие задачи по уравнению реакции по простому алгоритму.
Алгоритм решения химических задач:
1) Записать уравнение реакции, описанной в задании (не забыть уравнять!)
2) Если дана масса раствора и его массовая доля – найти массу растворённого вещества
3) Перевести массу вещества/объём газа в количество вещества
4) Сопоставить количество вещества известного к искомому и найти количество вещества искомого (помним: количества веществ всех участников реакции пропорциональны коэффициентам)
5) Вывести данные которые спрашивают: перевести количество вещества в объём газа/массу вещества/массовую долю вещества или массу раствора
Задача 1. Какой объём газа выделится при взаимодействии 25 г карбоната кальция с избытком раствора азотной кислоты?
1) Запишем уравнение реакции:
CaCO3 + 2HNO3 → Ca(NO3)2 + CO2↑ + H2O
2) Переведём массу известного карбоната кальция в количество вещества:
n(CaCO3) = m : M = 25 г : 100 г/моль = 0,25 моль
3) По коэффициентам видим, что количества веществ углекислого газа и карбоната кальция равны (перед обоими веществами коэффициент 1):
n(CO2) = n(CaCO3) = 0,25 моль
4) Переведём количество вещества углекислого газа в объём:
V(CO2) = n∙Vm = 0,25 моль∙22,4 л/моль = 5,6 л
Задача 2. К 200 г раствора серной кислоты с массовой долей 12,25% прилили избыток раствора нитрата бария. Определите массу выпавшего осадка.
1) Запишем уравнение реакции:
H2SO4 + Ba(NO3)2 → BaSO4↓+ 2HNO3
2) Вычислим массу растворенной серной кислоты (без воды):
m(H2SO4) = m(р-ра)∙ω : 100% = 200 г∙12,25% : 100% = 24,5 г
3) Переведём массу серной кислоты в количество вещества:
n(H2SO4)= m : М = 24,5 г : 98 г/моль = 0,25 моль
4) По коэффициентам в уравнении реакции видим, что серная кислота и сульфат бария соотносятся как 1:1, то есть равны:
n(BaSO4) = n(H2SO4) = 0,25 моль
5) Переведём количество вещества осадка в массу:
m(BaSO4) = n∙M = 0,25 моль∙233 г/моль = 58,25 г
Задача 3. При взаимодействии избытка раствора нитрата свинца (II) с 150 г раствора иодида калия выпало 10,45 г осадка. Рассчитайте массовую долю иодида калия в исходном растворе.
1) Запишем уравнение реакции:
2KI + Pb(NO3)2 → PbI2↓+ 2KNO3
2) Переведём массу осадка в количество вещества:
n(PbI2) = m : М = 10,45 г : 461 г/моль = 0,023 моль
3) По коэффициентам видно, что количество вещества иодида калия в 2 раза больше количества вещества осадка:
n(KI) = 2n(PbI2) = 0,046 моль
4) Тогда масса иодида калия будет равна:
m(KI) = n∙M = 0,046 моль∙166 г/моль = 7,636 г
5) Вычислим массовую долю иодида калия в растворе:
ω(KI) = m(в-ва) : m(р-ра)∙100% = 7,636 г : 150 г∙100% = 5%
Далее понятия и задачи, которых не будет в ОГЭ, но они, возможно, встретятся вам в школьной программе:
Чистое вещество – вещество, вступающее в реакцию, которое находится в смеси (и его в смеси преобладающее количество)
Примесь – вещество, не вступающее в реакцию, которое находится в смеси (и её в смеси небольшое количество)
Пример: известняк – минерал, содержащий чистое вещество карбонат кальция до 98% и примесь в виде глины
Формулы массовой доли примеси и чистого вещества в смеси:

Задача 4. При взаимодействии 24 г руды, содержащей карбонат железа (II), с избытком соляной кислоты выделилось 4,48 л углекислого газа. Определите массовую долю карбоната железа в руде.
1) Запишем уравнение реакции:
2HCl + FeCO3 → FeCl2 + CO2↑ + H2O
2) Вычислим количество вещества углекислого газа, который выделяется из карбоната в руде:
n(CO2) = V : Vm = 4,48 л : 22,4 л/моль = 0,2 моль
3) Сопоставим количество вещества карбоната и углекислого газа, по уравнению реакции они равны:
n(FeCO3) = n(CO2) = 0,2 моль
4) Найдём массу чистого вещества в смеси – карбоната железа:
m(FeCO3) = n∙M = 0,2 моль∙116 г/моль = 23,2 г
5) Вычислим массовую долю чистого вещества в смеси:
ω(FeCO3) = m(чист. в-ва) : m(образца)∙100% = 23,2 г : 24 г г∙100% = 96,7%
Задача 5. При растворении в избытке разбавленной серной кислоты цинка, содержащего 4,5% нерастворимых примесей, выделилось 2,24 л (н.у.) водорода. Определите массу растворённого металла.
1) Запишем уравнение реакции:
H2SO4 + Zn → ZnSO4+ H2↑
2) Вычислим количество вещества газа в реакции:
n(H2) = V : Vm = 2,24 л : 22,4 л/моль = 0,1 моль
3) Сопоставим по коэффициентам цинк и водород:
n(Zn) = n(H2) = 0,1 моль
4) Вычислим массу чистого цинка:
m(Zn) = n∙M = 0,1 моль∙65 г/моль = 6,5 г
5) Вычислим массовую долю чистого вещества в смеси (массовые доли чистого вещества и примеси в сумме дают 100%):
ω(Zn) = 100% – ω(примесей) = 100% – 4,5% = 95,5%
6) Перестроим формулу массовой доли для чистого вещества и вычислим массу образца цинка:
m(образца) = m(чист.ве-ва) : ω∙100% = 6,5 : 95,5%∙100% = 6,8 г
Задача 6. В избытке соляной кислоты растворили 1,506 г руды, содержащей 77% карбоната железа (II). Определите объём углекислого газа, выделившегося при этом.
1) Запишем уравнение реакции:
2HCl + FeCO3 → FeCl2 + CO2↑ + H2O
2) Вычислим массу чистого карбоната в смеси, который вступает в реакцию:
m(FeCO3) = m(образца)∙ω : 100% = 1,506 г∙77% : 100% = 1,16 г
3) Переведём массу в количество вещества:
n(FeCO3) = m : M = 1,16 г : 116 г/моль = 0,01 моль
4) По уравнению реакции сопоставим количество вещества газа и карбоната:
n(CO2) = n(FeCO3) = 0,01 моль
5) Найдём объём газа:
V(CO2) = n∙Vm = 0,01 моль∙22,4 л/моль = 0,224 л
Избыток – когда вещества взяли слишком много и оно всё не прореагировало
Недостаток – когда вещества взяли слишком мало и его не хватило, чтобы все реагенты полностью прореагировали
Важно: в задачах на избыток и недостаток подсчёт ведётся по недостатку, именно недостаток определяет полноту протекания реакции
Задача 7. Вычислите массу сульфида алюминия, который образуется при реакции 50 г алюминия и 70 г серы.
1) Запишем уравнение реакции:
2Al + 3S → Al2S3
2) Вычислим количества веществ серы и алюминия:
n(Al) = m : M = 50 г : 27 г/моль = 1,85 моль
n(S) = m : M = 70 г : 32 г/моль = 2,19 моль
3) Найдём избыток и недостаток – делим количество вещества алюминия на коэффициент перед ним и количество вещества серы на коэффициент перед ней и сравниваем:
1,85 : 2 = 0,925 > 2,19 : 3 = 0,73 моль
4) Так как в неравенстве видно, что сера находится в недостатке, то количество вещества продукта определяем по ней (алюминий в избытке и часть его не прореагирует):
n(Al2S3) = n(S) : 3 = 0,73 моль
5) Переводим количество вещества в массу:
m(Al2S3) = n∙M = 0,73 моль∙150 г/моль = 109,5 г
Выход – это коэффициент, определяющий полноту протекания химической реакции; он численно равен отношению количества (массы, объема) реально полученного продукта к его теоретическому количеству (массе, объему)
Пример: готовим яичницу, взяв 100 г яиц и 100 г бекона; масса теоретическая в таком случае составит 200 г, но на деле получаем 150 г яичницы с беконом – это масса практическая; тогда потери составят 50 г, а выход 150/200 = 0,75 или 75%
Формулы вычисления выхода:
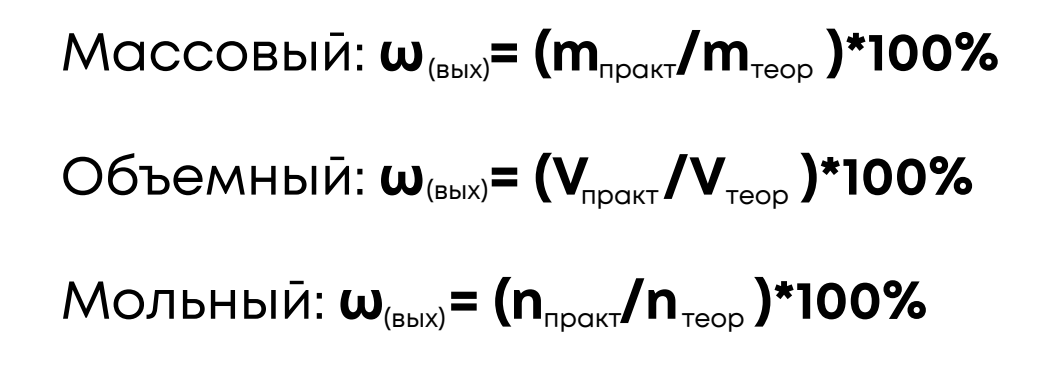
Задача 8. Из 200 кг карбоната кальция при взаимодействии с азотной кислотой был получен нитрат кальция массой 311,6 кг. Вычислите выход (%) данной реакции.
1) Запишем уравнение реакции:
CaCO3 + 2HNO3 → Ca(NO3)2 + CO2↑ + H2O
2) Вычислим количество вещества карбоната кальция, переведя килограммы в граммы:
n(CaCO3) = m : M = 200000 г : 100 г/моль = 2000 моль
3) Сопоставим количество вещества карбоната кальция и нитрата кальция в реакции, соотносятся как 1 к 1 или равны:
n(Ca(NO3)2) = n(CaCO3) = 2000 моль
4) Вычислим массу нитрата кальция теоретическую:
n(Ca(NO3)2) = n∙M = 2000 моль∙164 г/моль = 328000 г = 328 кг
5) Найдём массовый выход реакции:
ωвых. = mпр. : mтеор.∙100% = 311,6 кг : 328 кг∙100% = 95%