Частицы в кристаллах и аморфных веществах удерживаются друг с другом с помощью особого взаимодействия – химической связи.
Химическая связь – это взаимодействие атомов (их ядер и валентных электронов), которая обуславливает устойчивость молекулы или кристалла как единого целого
При образовании связи атомы стремятся к образованию идеальной восьмиэлектронной оболочки благородных газов, это называется «правилом октета». При этом наблюдается выигрыш в энергии: при образовании связи она выделяется, при разрыве – затрачивается.
Свойства химической связи:
1) Направленность связи придаёт форму молекулам
2) Насыщаемость связи даёт определённое число связей (валентность)
3) Полярность связи возникает из-за разности в электроотрицательности
4) Поляризуемостью связи называют способность электронной плотности смещаться из-за внешнего электрического поля
Кратность связи – число общих электронных пар между атомами, традиционно обозначается количеством черточек между атомами

Длина связи – расстояние между ядрами атомов, образующих связь, можно оценить по кратности и радиусам атомов
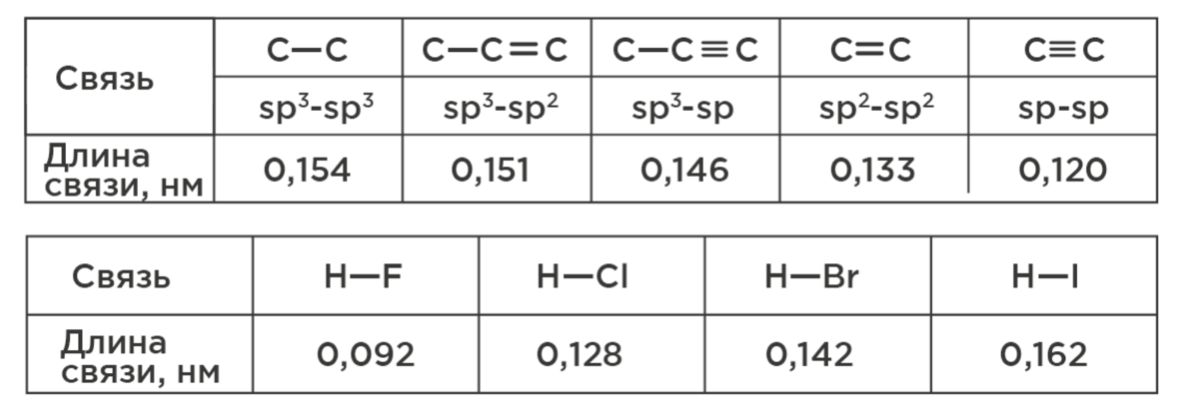
Энергия связи – энергия, необходимая для разрыва связи и мера её прочности; чем длиннее химическая связь, тем меньше энергия и наоборот

Типы химических связей
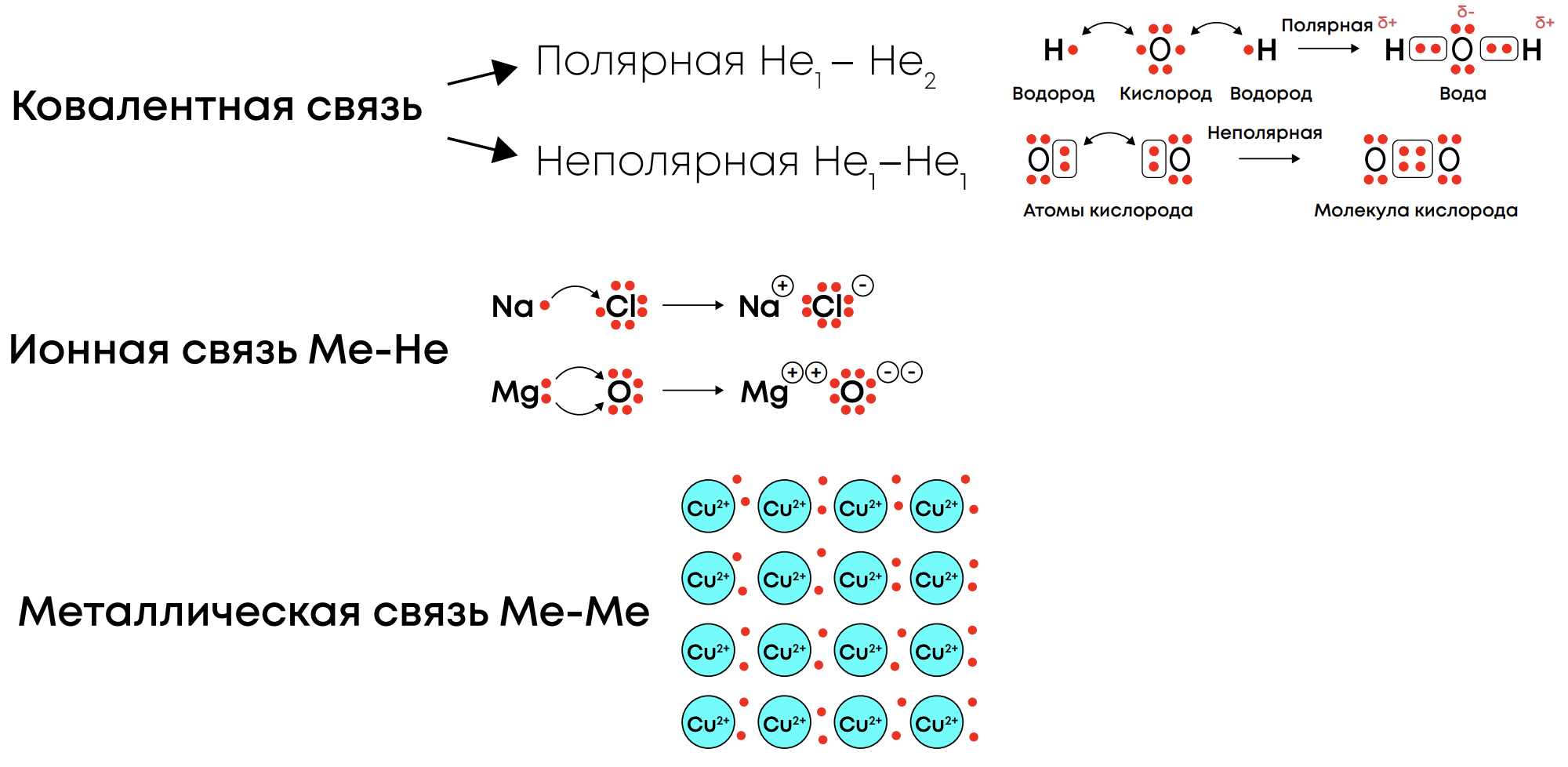
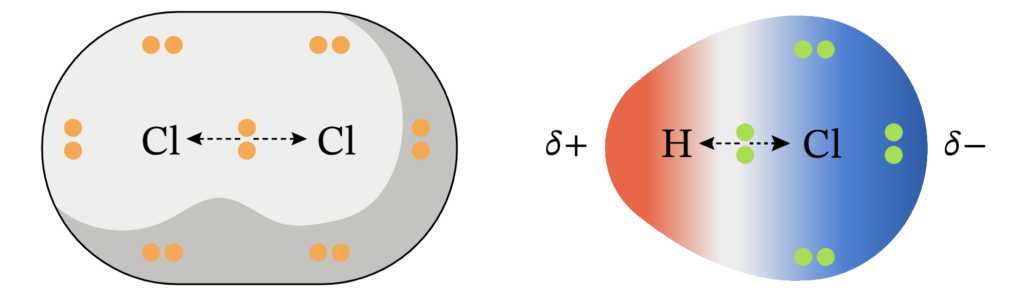
Ковалентная связь – химическая связь, образованная за счёт общей пары электронов между двумя атомами с перекрыванием атомных орбиталей
Ковалентная полярная связь образуется между атомами разных неметаллов, где один атом оттягивает электронную плотность на себя образуются полюса
Ковалентная неполярная связь образуется между атомами одинаковых неметаллов, где электронная плотность распределяется равномерно и полюсов не образуется
Механизмы образования ковалентной связи:
Обменный механизм: каждый атом вносит в общую электронную пару по одному электрону
Донорно-акцепторный механизм: атом-донор вносит свою электронную пару в химическую связь, а атом-акцептор принимает её
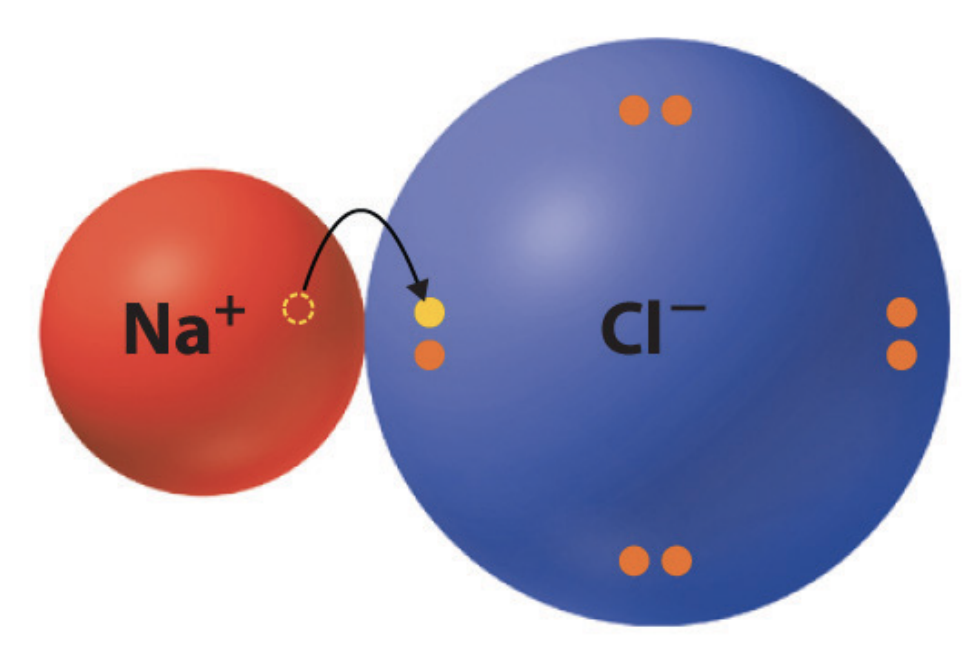
Ионная связь – химическая связь, образуемая за счёт притяжения разнозаряженных ионов, когда разность в электроотрицательности настолько велика, что происходит отрыв электронов и образование заряженных частиц (катионов и анионов)
Ионная связь образуется между металлами и неметаллами (NaCl), между другими ионами из таблицы растворимости (NH4NO3)
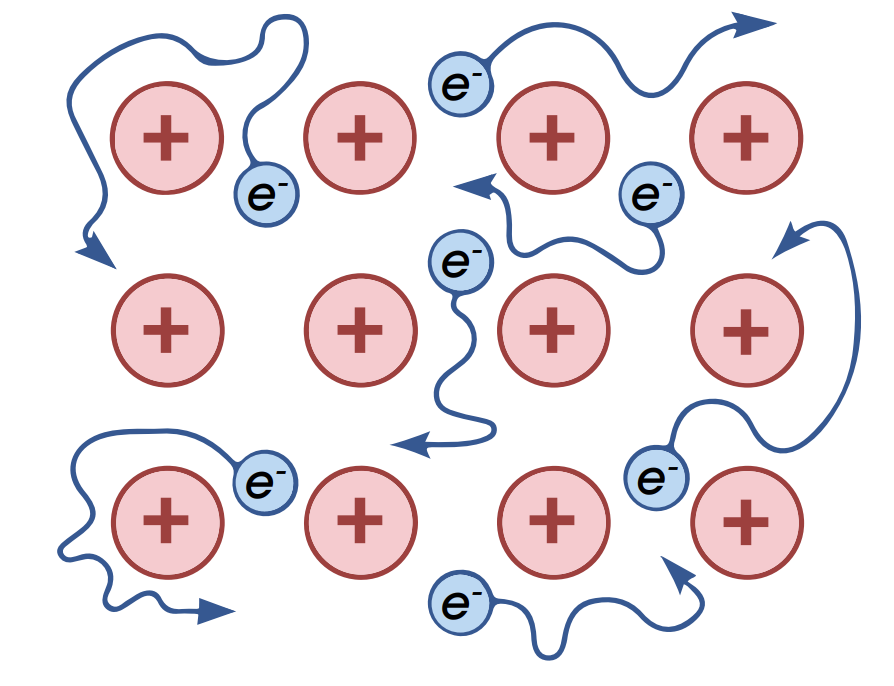
Металлическая связь – химическая связь в металлах и их сплавов (Cu, Na, бронза), когда образуется металлический кристалл: свободные электроны (электронный газ) находятся между положительно заряженными ионами металлов
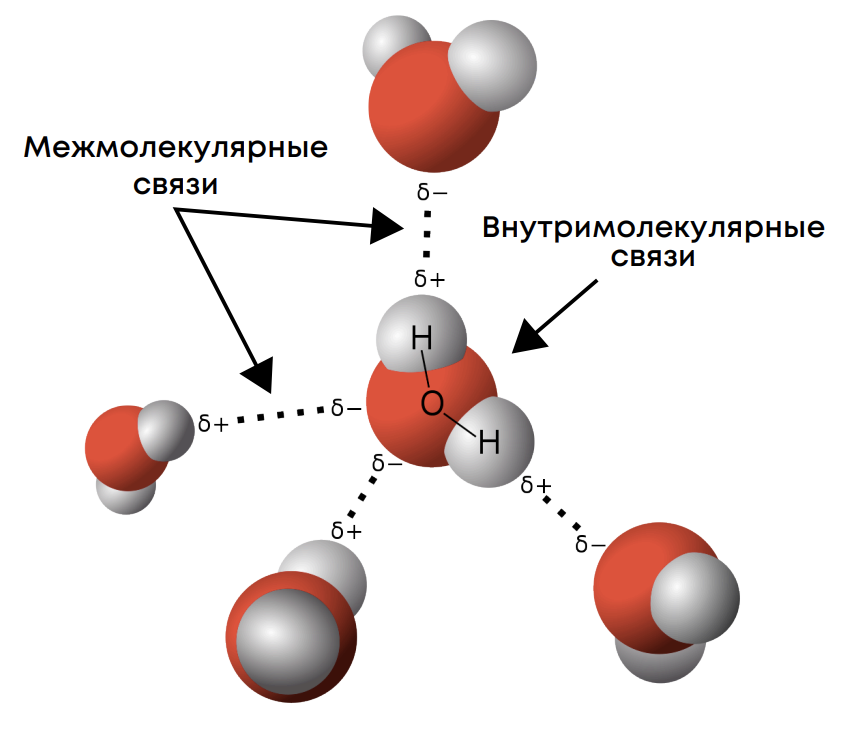
Помимо базовых типов связей существует водородая связь, которая не встречается в ОГЭ: она образуется чаще всего между молекулами. Водородная связь присутствует в молекулах со связями Н-О, Н-N, H-F. Например она есть в воде H2O, перекиси водорода H2O2, аммиаке NH3, фтороводороде HF.
Примеры химических связей разных типов:
Ковалентная полярная – NH3, H2O, SO3
Ковалентная неполярная – Cl2, S8, O3
Ионная – NaCl, K2SO3, NH4Br
Металлическая – Cu, Fe, K