Мы уже выяснили с вами, что химические элементы имеют краткие условные обозначения – символы элементов. Было бы очень долго писать каждый раз «магний», «азот» или «натрий». Поэтому мы обозначаем их латинские названия легли в основу кратких символов: Mg, N, Na.
Сами вещества также кратко обозначают с помощью химических формул веществ, которые складываются из химических элементов, входящих в состав вещества. Формулы бывают: молекулярными (отображение состава молекулы вещества) и структурными (отображение структуры молекулы). Количество элемента в формуле отображается снизу цифрой после символа – индексом.

P.S. Сразу небольшая оговорка для поваренной соли NaCl формула не обозначает состав молекулы, т.к. вещество представляет собой ионный кристалл и молекул там никаких нет. В случае немолекулярных соединений формула обозначает формульную единицу – простейшую формулу для пригодную для обозначения состава вещества (поваренная соль/хлорид натрия состоит из огромного количества катионов натрия и анионов хлора в соотношении 1:1).
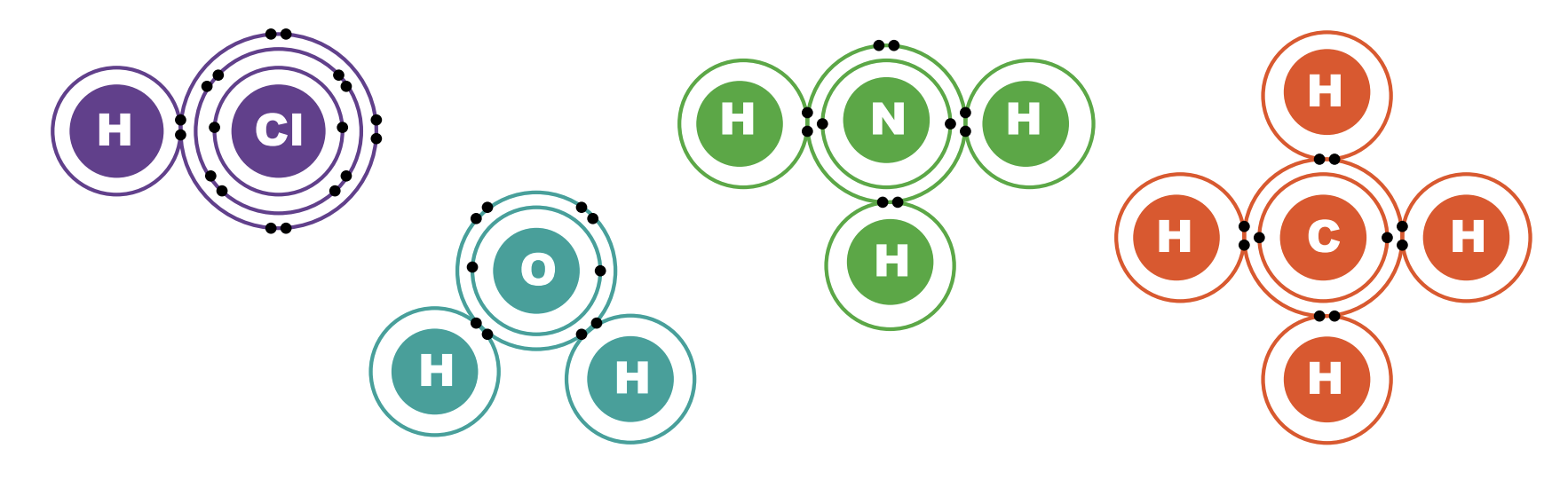
Помимо молекулярных и структурных формул существуют электронные формулы Льюиса (октетные формулы), где вместо изображения химических палочек в виде черточек показаны электронные пары (1 ковалентная связь = 2 общих электрона = 1 общая электронная пара). Остальные валентные электроны атомов также обозначаются в виде точек.
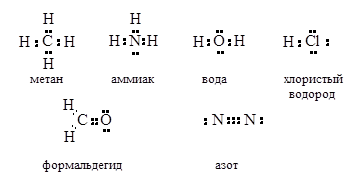
Как вы, наверное, уже заметили: атомы образуют какое-то определенное количество химических связей в формулах. Это свойство атомов химических элементов называется валентностью.
Валентность – это способность атома образовывать определенное количество ковалентных химических связей; иначе: количество электронных пар, которыми данный атом связан с другими атомами
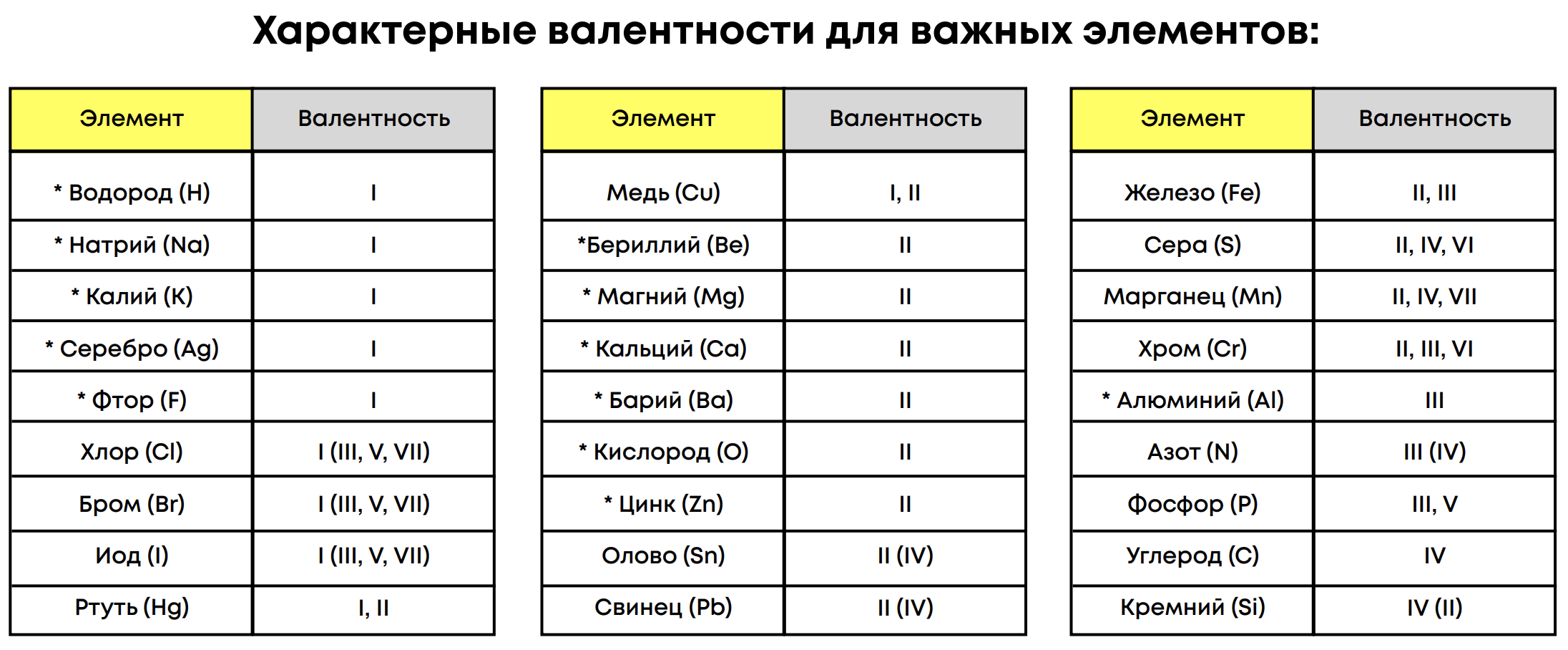
Валентность элемента может быть постоянной (во всех соединениях одинаковая) или переменной (отличается от соединения к соединению). Высшая валентность как правила равна номеру группы, низшая валентность равна 8 – номер группы.
Исключения:
1. Азот: высшая валентность IV
2. Кислород: высшая валентность II
3. Фтор: высшая валентность I
4. Побочные металлы IB и VIIIB: высшая Cu – II, Fe – III
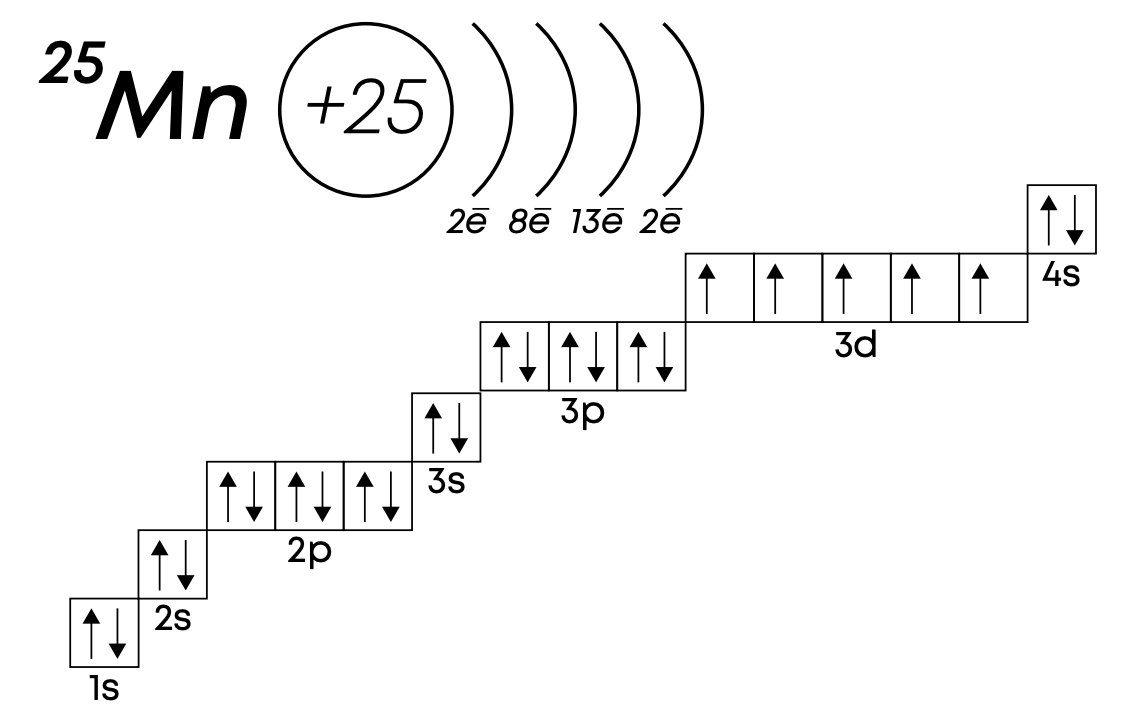
P.S. Валентные способности атомов химических элементов зависят от их электронной конфигурации и валентных электронов. Ранее мы сказали, что валентные электроны – это внешние электроны, но элементы побочных групп имеют валентные электроны не только на внешнем уровне, но и на предвнешнем, точнее на d-подуровне. Например, марганец имеет 2 внешних электрона на 4s-подуровне, но валентными будут являться также 5 электронов на 3d-подуровне.
Постоянные валентности для элементов стоит запомнить, т.к. они пригодятся в составлении формул и определении переменных валентностей.
Постоянные валентности:
H, F – I
Металлы IА группы – I
O, металлы IIA группы, Zn – II
Al – III
Так зачем же нам нужны эти валентности? Самое важное их применение – составление химических формул бинарных соединений (состоящих из 2 химических элементов).
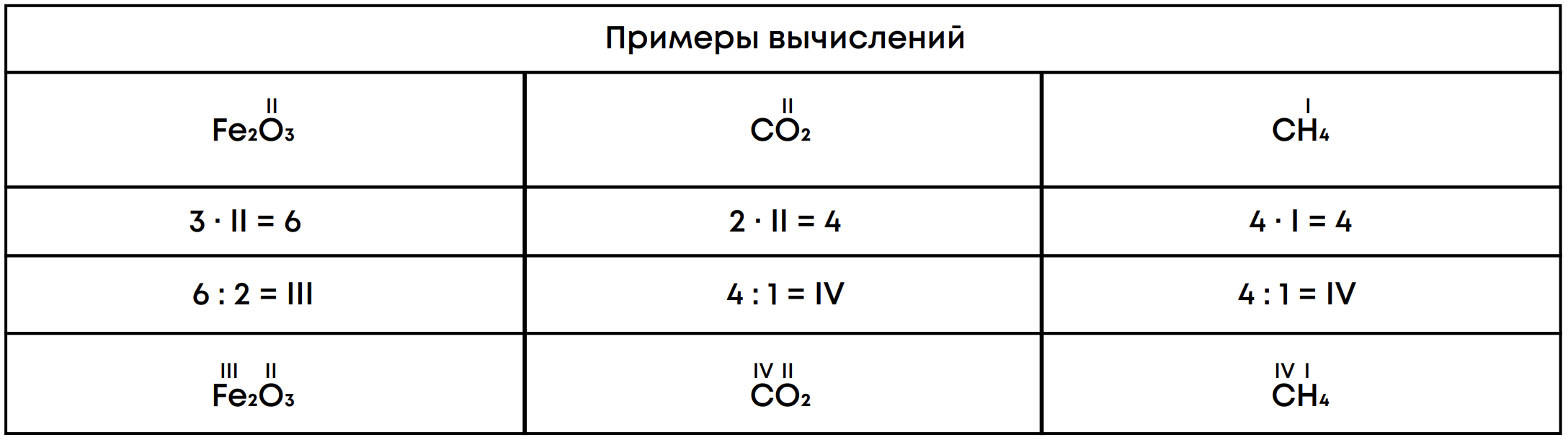
Алгоритм составления формулы по валентности:
1. Записать символы химических элементов и их валентности
2. Найти наименьшее общее кратное валентностей элементов
3. Разделить кратное на валентности элементов и вывести индексы
4. Записать индексы в формулу

Также, мы можем определить по постоянной валентности переменную в бинарных формулах.
Алгоритм определения валентности по формуле
1. Записать формулу вещества и обозначить известную валентность
2. Умножить известную валентность на количество атомов элемента
3. Разделить полученное число на количество атомов другого элемента
4. Вывести неизвестную валентность